Hvilken slags kemiske ændringer producerer varme?
forbrænding: Dette er det mest almindelige eksempel, hvor et brændstof reagerer med ilt for at frigive energi som varme og lys. Eksempler inkluderer brændende træ, naturgas eller benzin.
neutraliseringsreaktioner: Når syrer og baser reagerer, frigiver de varme og danner salt og vand.
Eksplosioner: Dette er hurtige eksoterme reaktioner, der producerer en stor mængde varme og gas på kort tid.
nukleare reaktioner: Fission og fusionsreaktioner frigiver enorme mængder varme, som det ses i atomkraftværker og atomvåben.
Andre eksempler:
* respiration: Den proces, hvormed levende organismer konverterer mad til energi frigiver varme.
* Rusting: Reaktionen af jern med ilt til dannelse af jernoxid (RUST) frigiver varme.
* Blanding af visse kemikalier: Nogle kemikalier frigiver varme, når de blandes, som natriumhydroxid med vand.
Nøglefaktorer, der bestemmer, om en reaktion er eksoterm eller endotermisk (absorberer varme) er:
* Bond Breaking and Formation: At bryde obligationer kræver energi, mens dannelsen af obligationer frigiver energi. Hvis energien frigivet fra bindingsdannelse er større end den energi, der kræves for at bryde bindinger, er reaktionen eksoterm.
* entalpiændring: Enthalpiændringen (ΔH) af en reaktion er forskellen mellem entalpien af produkterne og reaktanternes entalpi. Exotermiske reaktioner har en negativ ΔH, hvilket indikerer, at varme frigøres.
At forstå de kemiske ændringer, der producerer varme, hjælper os med at bruge energi i forskellige anvendelser, fra at generere elektricitet til at tænde vores kroppe.
Sidste artikelHvad er processen med at adskille kemikalier i en medicin?
Næste artikelHvad hedder Compound med Formula SNCL2?
 Varme artikler
Varme artikler
-
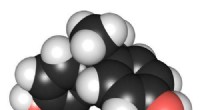 Nye katalysatorer fjerner effektivt og hurtigt BPA fra vand3D -kemisk struktur af bisphenol A. Kredit:Edgar181 via Wikimedia Commons Carnegie Mellon University -kemiker Terrence J. Collins har udviklet en tilgang, der hurtigt og billigt fjerner mere end 9
Nye katalysatorer fjerner effektivt og hurtigt BPA fra vand3D -kemisk struktur af bisphenol A. Kredit:Edgar181 via Wikimedia Commons Carnegie Mellon University -kemiker Terrence J. Collins har udviklet en tilgang, der hurtigt og billigt fjerner mere end 9 -
 Natures frostvæske giver en formel for mere holdbar betonDette billede viser, hvordan iskrystaller, der binder til polymermolekylerne, oplever dynamisk isformning, skifte fra en kugle til en afrundet sekskant, som forskerne kalder citronis. Kredit:Living Ma
Natures frostvæske giver en formel for mere holdbar betonDette billede viser, hvordan iskrystaller, der binder til polymermolekylerne, oplever dynamisk isformning, skifte fra en kugle til en afrundet sekskant, som forskerne kalder citronis. Kredit:Living Ma -
 Video:Hvorfor har vi ikke syntetisk blod endnu?Kredit:The American Chemical Society Der doneres millioner af liter blod rundt om i verden hvert år, men der er stadig ikke nok til alle, der har brug for det. Kemikere har i et århundrede forsøgt
Video:Hvorfor har vi ikke syntetisk blod endnu?Kredit:The American Chemical Society Der doneres millioner af liter blod rundt om i verden hvert år, men der er stadig ikke nok til alle, der har brug for det. Kemikere har i et århundrede forsøgt -
 Mod 4D-print med strukturelle farverFarven på den blå tarantel (Poecilotheria metallica) kommer fra præcist arrangerede nanokrystaller. Det krystallinske array fungerer som et spejl, der kun reflekterer en bestemt bølgelængde af indkomm
Mod 4D-print med strukturelle farverFarven på den blå tarantel (Poecilotheria metallica) kommer fra præcist arrangerede nanokrystaller. Det krystallinske array fungerer som et spejl, der kun reflekterer en bestemt bølgelængde af indkomm


