Hvad er den samlede ladning for de fleste forbindelser?
Her er hvorfor:
* ioniske forbindelser: Disse dannes af den elektrostatiske tiltrækning mellem positivt ladede ioner (kationer) og negativt ladede ioner (ANION). Antallet af kationer og anioner i forbindelsen bestemmes af ladningerne for hver ion, hvilket sikrer, at den samlede ladning er neutral. For eksempel dannes NaCl (natriumchlorid) af kombinationen af Na+ (natriumion) og Cl- (chloridion) i et forhold på 1:1.
* kovalente forbindelser: Disse dannes ved deling af elektroner mellem atomer. Mens individuelle atomer inden for forbindelsen kan have delvis ladning, er det samlede molekyle typisk neutral, fordi de delte elektroner bidrager til den samlede elektronegativitet af molekylet.
Undtagelser:
* polyatomiske ioner: Dette er grupper af atomer, der fungerer som en enkelt enhed med en samlet ladning. Eksempler inkluderer sulfat (SO4^2-) og ammonium (NH4+). Disse ioner kan derefter danne forbindelser med andre ioner, hvilket resulterer i en forbindelse med en nettoafgift.
* komplekse ioner: Dette er molekyler, der har en nettoopladning, typisk på grund af tilstedeværelsen af en metalion og ligander. For eksempel har den komplekse ion [Cu (NH3) 4] 2+ en nettoafgift på +2.
Sammenfattende, mens de fleste forbindelser er neutrale, er der undtagelser, hvor den samlede ladning kan være positiv, negativ eller nul afhængigt af den specifikke sammensætning og struktur af forbindelsen.
 Varme artikler
Varme artikler
-
 Blistervæske kan hjælpe med at diagnosticere forbrændingens sværhedsgradKredit:American Chemical Society Alvorlige forbrændinger kan efterlade fysiske og psykiske ar, især hos børn. Når en forbrændingspatient kommer ind på klinikken, læger bruger faktorer som forbrænd
Blistervæske kan hjælpe med at diagnosticere forbrændingens sværhedsgradKredit:American Chemical Society Alvorlige forbrændinger kan efterlade fysiske og psykiske ar, især hos børn. Når en forbrændingspatient kommer ind på klinikken, læger bruger faktorer som forbrænd -
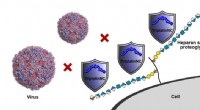 Metalbaserede forbindelser baner vejen for nye antivirale behandlingerTriplatinNC, repræsenteret i blåt, binder sig til celleoverfladereceptorer for at beskytte celler mod virusinfektion (her to enterovirus 71 partikler, repræsenteret til venstre). Kredit:Benjamin Baill
Metalbaserede forbindelser baner vejen for nye antivirale behandlingerTriplatinNC, repræsenteret i blåt, binder sig til celleoverfladereceptorer for at beskytte celler mod virusinfektion (her to enterovirus 71 partikler, repræsenteret til venstre). Kredit:Benjamin Baill -
 Nye materialer hjælper med at udvide volumetrisk 3-D-printVed hjælp af en tilpasset volumetrisk additiv fremstilling 3D-printer, Lawrence Livermore-forskere var i stand til at bygge hårde og stærke, samt strækbar og fleksibel, genstande næsten øjeblikkeligt
Nye materialer hjælper med at udvide volumetrisk 3-D-printVed hjælp af en tilpasset volumetrisk additiv fremstilling 3D-printer, Lawrence Livermore-forskere var i stand til at bygge hårde og stærke, samt strækbar og fleksibel, genstande næsten øjeblikkeligt -
 Den japanske nobelpristager for kemi Shimomura dør, 90 år gammelI denne 7. dec. 2008, fil foto, Nobelpristageren i kemi Osamu Shimomura taler under pressekonferencen på Det Kongelige Svenske Videnskabsakademi i Stockholm. Sverige. Shimomura, en af tre forskere,
Den japanske nobelpristager for kemi Shimomura dør, 90 år gammelI denne 7. dec. 2008, fil foto, Nobelpristageren i kemi Osamu Shimomura taler under pressekonferencen på Det Kongelige Svenske Videnskabsakademi i Stockholm. Sverige. Shimomura, en af tre forskere,
- Fald i grønt energiforbrug kan opveje emissionsfordelene fra COVID-æraen
- Ionosfæren vokser til sin største tykkelse, i hvilken tid?
- Parker Solar Probe og det mærkelige tilfælde af den varme corona
- Månen er fuldt synlig for observatører på jorden?
- Jord ryddet fra regnskoven til landbrug?
- Indonesiske skovbrande et problem, der kan løses


