Hvad fortæller en sammensat formel dig?
1. Identitet: Den identificerer de elementer, der er til stede i forbindelsen. For eksempel fortæller H₂O os, at vand indeholder brint (H) og ilt (O).
2. Forhold: Det angiver det relative antal atomer for hvert element i forbindelsen. Underskrifterne i formlen repræsenterer dette forhold. For eksempel fortæller H₂O os, at der er to hydrogenatomer for hvert iltatom.
3. Molekylvægt: Ved hjælp af elementernes atomvægte kan du beregne molekylvægten af forbindelsen. Dette hjælper med at bestemme massen af et enkelt molekyle.
4. Empirisk formel: Forbindelsesformlen kan også udtrykkes som en empirisk formel, der repræsenterer det enkleste hele antal atomer i forbindelsen. For eksempel er den empiriske formel for glukose (c₆h₁₂o₆) ch₂o.
5. Strukturel information: Nogle gange kan formlen give nogle strukturelle oplysninger. For eksempel antyder en formel som ch₃cooh tilstedeværelsen af en carboxylsyregruppe. For detaljerede strukturelle oplysninger har du imidlertid brug for en strukturel formel.
Sammenfattende giver en sammensat formel information om de tilstedeværende elementer, deres relative overflod og den samlede sammensætning af forbindelsen. Det er en kortfattet måde at repræsentere den kemiske sammensætning af et stof.
 Varme artikler
Varme artikler
-
 Superfleksible aerogeler er meget effektive absorbenter, termiske isolatorer, og tryksensorerKredit:Wiley Luftig, Luftigere, Aerogel. Indtil nu, skørhed har begrænset den praktiske anvendelse af disse sarte faste stoffer, som næsten udelukkende består af luftfyldte porer. Dette kan nu ænd
Superfleksible aerogeler er meget effektive absorbenter, termiske isolatorer, og tryksensorerKredit:Wiley Luftig, Luftigere, Aerogel. Indtil nu, skørhed har begrænset den praktiske anvendelse af disse sarte faste stoffer, som næsten udelukkende består af luftfyldte porer. Dette kan nu ænd -
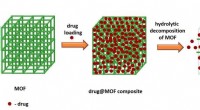 Bare tilsæt vand:Kemikere foreslår en løsning for uopløselige lægemidlerPå billedet er en skematisk repræsentation af et lægemiddel indkapslet i MOF, efterfulgt af den øjeblikkelige frigivelse af lægemidlet fra dets sammensætning. Kredit:Adam Matzger og Suresh Kuruthu
Bare tilsæt vand:Kemikere foreslår en løsning for uopløselige lægemidlerPå billedet er en skematisk repræsentation af et lægemiddel indkapslet i MOF, efterfulgt af den øjeblikkelige frigivelse af lægemidlet fra dets sammensætning. Kredit:Adam Matzger og Suresh Kuruthu -
 Forbedret affaldsseparering ved hjælp af superstabil magnetisk væskeTo magnetiske væsker med en magnet i midten. Til venstre:en ustabil magnetisk væske, hvor de magnetiske partikler i væsken trækkes mod magneten. Til højre:en væske, der forbliver stabil i et magnetfel
Forbedret affaldsseparering ved hjælp af superstabil magnetisk væskeTo magnetiske væsker med en magnet i midten. Til venstre:en ustabil magnetisk væske, hvor de magnetiske partikler i væsken trækkes mod magneten. Til højre:en væske, der forbliver stabil i et magnetfel -
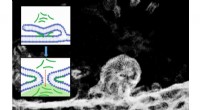 Hvordan trænger peptider ind i celler? To sider af samme møntElektronmikroskopibillede af en todelt cellemembran og det tilsvarende molekylære skema for processen. Kredit:@ IOCB Prag Den simple transport af lægemidler direkte ind i cellerne er et af de prim
Hvordan trænger peptider ind i celler? To sider af samme møntElektronmikroskopibillede af en todelt cellemembran og det tilsvarende molekylære skema for processen. Kredit:@ IOCB Prag Den simple transport af lægemidler direkte ind i cellerne er et af de prim
- Hvordan kan vi håndtere kemi af surt regn?
- Klimaets indvirkning på flodkemien i hele USA
- Hvordan virkede ændring af Catalase PH -virkningen af katalase?
- Klare ligheder mellem Boeing-ulykker i Etiopien, Indonesien
- Lys-inducerede ændringer i form driver en pumpe i en marin bakterie
- Konstruerede proteiner klæber som lim - selv i vand


