Hvad er meningen med polyvalent atom?
Her er en sammenbrud:
* valence: Antallet af elektroner, som et atom kan få, tabe eller dele for at danne kemiske bindinger.
* polyvalent: Har flere valenser.
Eksempler:
* carbon (c): Carbon har en valens på 4, hvilket betyder, at den kan danne fire bindinger. Dette er grunden til, at kulstof er rygraden i organiske molekyler og kan danne komplekse strukturer som kæder, ringe og forgrenede strukturer.
* svovl (r): Svovl har en valens på 2, 4 eller 6 afhængigt af det kemiske miljø. Det kan danne forbindelser med forskellige antal bindinger til andre atomer.
* Overgangsmetaller: Disse metaller har ofte flere valenser, hvilket fører til dannelse af forskellige oxidationstilstande og en række kemiske forbindelser.
Nøglepunkter:
* Polyvalente atomer er essentielle for dannelsen af forskellige og komplekse molekyler.
* Evnen til at danne flere bindinger muliggør oprettelse af en lang række kemiske forbindelser med unikke egenskaber.
* Begrebet polyvalens er afgørende for at forstå arten af kemisk binding og mangfoldigheden af kemiske reaktioner.
Fortæl mig, hvis du har andre spørgsmål!
 Varme artikler
Varme artikler
-
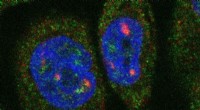 Design af lægemidler rettet mod en anden del af livets kodeIndividuelle RNA-molekyler fluorescerer inde i en brystkræftcelle. Kredit:Sunjong Kwon, Oregon Health &Science University, via Flickr De fleste lægemidler virker ved at pille ved proteiners adfærd
Design af lægemidler rettet mod en anden del af livets kodeIndividuelle RNA-molekyler fluorescerer inde i en brystkræftcelle. Kredit:Sunjong Kwon, Oregon Health &Science University, via Flickr De fleste lægemidler virker ved at pille ved proteiners adfærd -
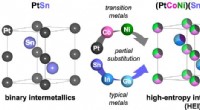 Carbonneutraliserende propylenproduktion katalyserer ændringer i petrokemisk teknikPlatin (Pt) og tin (Sn) steder i intermetallisk PtSn er delvist substitueret med henholdsvis Cobalt og nikkel (Co/Ni) og Indium og Gallium (In/Ga), hvilket danner en PtSn-type højentropi intermetallis
Carbonneutraliserende propylenproduktion katalyserer ændringer i petrokemisk teknikPlatin (Pt) og tin (Sn) steder i intermetallisk PtSn er delvist substitueret med henholdsvis Cobalt og nikkel (Co/Ni) og Indium og Gallium (In/Ga), hvilket danner en PtSn-type højentropi intermetallis -
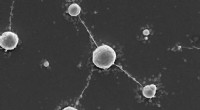 Wolfram som interstellar strålingsafskærmning?Wolfram polyoxometalater som livsopretholdende uorganiske rammer. Enkeltceller af M. sedula efter dyrkning med wolfram-bærende W-POM. Kredit:© Tetyana Milojevic Et kogepunkt på 5900 grader Celsius
Wolfram som interstellar strålingsafskærmning?Wolfram polyoxometalater som livsopretholdende uorganiske rammer. Enkeltceller af M. sedula efter dyrkning med wolfram-bærende W-POM. Kredit:© Tetyana Milojevic Et kogepunkt på 5900 grader Celsius -
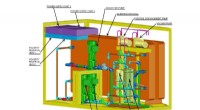 Nrl modtager patent på kulstoffangstanordning - et nøgletrin i produktion af syntetisk brændstof …E-CEM (Electrolytic-Cation Exchange Module), udviklet ved US Naval Research Laboratory (NRL), giver flåden mulighed for at producere de råmaterialer, der er nødvendige for at udvikle syntetisk brændst
Nrl modtager patent på kulstoffangstanordning - et nøgletrin i produktion af syntetisk brændstof …E-CEM (Electrolytic-Cation Exchange Module), udviklet ved US Naval Research Laboratory (NRL), giver flåden mulighed for at producere de råmaterialer, der er nødvendige for at udvikle syntetisk brændst
- Hvordan flydata kan hjælpe med at estimere økonomisk aktivitet
- Forsker udforsker at bruge nanopartikler til at reducere størrelsen af dybtliggende tumorer
- Hvad er atomer sammensat af?
- Routing-apps kan levere realtidsindsigt i trafikemissioner
- Hvordan dannes stjernernes binære filer?
- Robotter går, tale, skænke øl og overtage CES tech show


