Hvilke elektroner er involveret i kemiske bindinger?
Her er hvorfor:
* valenselektroner er elektronerne i det yderste energiniveau af et atom. Det er dem, der er længst fra kernen og har derfor den svageste tiltrækning til atomens kerne.
* Kemiske obligationer form, når atomer deler eller overfører valenselektroner for at opnå en stabil elektronkonfiguration. Denne stabilitet opstår ved at have en fuld ydre skal af elektroner som de ædle gasser.
Eksempler:
* kovalent binding: Atomer deler valenselektroner til dannelse af et stabilt molekyle. I vand (H₂O) deler hydrogenatomer for eksempel deres enkelt valenselektron med ilt, som har seks valenselektroner. Denne deling resulterer i et stabilt molekyle med to delte par elektroner.
* ionisk binding: Et atom overfører valenselektroner til et andet atom, hvilket skaber ioner med modsatte ladninger, der tiltrækker hinanden. For eksempel mister natriumchlorid (NaCl) i natriumchlorid sin enkelt valenselektron til chlor (CL) og bliver en positivt ladet ion (Na+). Klor vinder elektronet og bliver en negativt ladet ion (Cl-). De modsatte afgifter tiltrækker og danner en ionisk binding.
Sammenfattende er det valenselektroner, dem i det yderste energiniveau, der spiller en nøglerolle i dannelsen af kemiske bindinger.
Sidste artikelNår salt opløses i vand, hvad er det opløste og opløsningsmiddel?
Næste artikelHvad er det opløste og opløsningsmiddel i glas?
 Varme artikler
Varme artikler
-
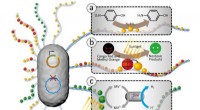 Konstruerede bakterielle biofilm, der immobiliserer nanopartikler, muliggør forskellige katalytiske…Forskellige katalytiske anvendelser af tunable funktionel E coli biofilm med forankrede nanoobjekter. (a) De biofilmforankrede Au NPer muliggør den genanvendelige katalytiske reduktion af den giftig
Konstruerede bakterielle biofilm, der immobiliserer nanopartikler, muliggør forskellige katalytiske…Forskellige katalytiske anvendelser af tunable funktionel E coli biofilm med forankrede nanoobjekter. (a) De biofilmforankrede Au NPer muliggør den genanvendelige katalytiske reduktion af den giftig -
 AI -algoritme identificerer ny forbindelse, der potentielt kan bruges til fotoniske enheder, biologi…Kredit:CC0 Public Domain Når ordene kunstig intelligens (AI) kommer til at tænke på, dine første tanker kan være super-smarte computere, eller robotter, der udfører opgaver uden at have brug for h
AI -algoritme identificerer ny forbindelse, der potentielt kan bruges til fotoniske enheder, biologi…Kredit:CC0 Public Domain Når ordene kunstig intelligens (AI) kommer til at tænke på, dine første tanker kan være super-smarte computere, eller robotter, der udfører opgaver uden at have brug for h -
 Mine efter guld med en computerDisse billeder viser nogle af de fysiske egenskaber ved nanoporøst guld ved forskellige forstørrelser. Kredit:Texas A&M University Ingeniører fra Texas A&M University og Virginia Tech rapporterer
Mine efter guld med en computerDisse billeder viser nogle af de fysiske egenskaber ved nanoporøst guld ved forskellige forstørrelser. Kredit:Texas A&M University Ingeniører fra Texas A&M University og Virginia Tech rapporterer -
 Forskere opdager superelastisk formhukommelsesmaterialeMaterialevidenskab og ingeniørprofessor Seok-Woo Lee og kolleger har opdaget superelastiske formhukommelsesegenskaber i et materiale, der kunne bruges under de hårdeste forhold, såsom det ydre rum. Kr
Forskere opdager superelastisk formhukommelsesmaterialeMaterialevidenskab og ingeniørprofessor Seok-Woo Lee og kolleger har opdaget superelastiske formhukommelsesegenskaber i et materiale, der kunne bruges under de hårdeste forhold, såsom det ydre rum. Kr
- Undersøgelse af nye måder at bruge sekundære logmaterialer på
- National undersøgelse af nanomaterialetoksicitet sætter scenen for politikker til håndtering af s…
- Hvilket grundstof indeholder HCl ikke?
- Hvordan opfører meget små partikler sig ved meget høje temperaturer?
- Hvordan handler planter hurtigt for at bekæmpe infektioner?
- Hvad er oxidationstallet for aluminiumkarbonat?


