Hvad er to måder, hvorpå opløsningsmiddel påvirker solventets egenskaber?
1. Kolligative egenskaber: Dette er egenskaber ved en opløsning, der udelukkende afhænger af koncentrationen af opløste partikler, ikke deres identitet. Her er nogle eksempler:
* damptryk sænkning: Tilstedeværelsen af et opløst stof reducerer opløsningsmidlets damptryk. Dette skyldes, at de opløste molekyler optager nogle af overfladearealet af væsken, hvilket gør det sværere for opløsningsmiddelmolekyler at flygte ind i gasfasen.
* kogepunkthøjde: Tilsætning af et opløst stof hæver opløsningsmidlets kogepunkt. Dette skyldes, at opløsningspartiklerne forstyrrer opløsningsmidlets molekylernes evne til at flygte ind i gasfasen, hvilket betyder, at væsken er nødt til at nå en højere temperatur til kogning.
* frysningspunktdepression: Tilsætning af et opløst stof sænker opløsningsmidlets frysepunkt. Dette skyldes, at de opløste partikler forstyrrer det regelmæssige arrangement af opløsningsmiddelmolekyler, der er nødvendige for at danne et fast stof.
* osmotisk tryk: Osmose er bevægelsen af opløsningsmiddelmolekyler på tværs af en semipermeabel membran fra en region med lavere opløst koncentration til et område med højere opløst koncentration. Osmotisk tryk er det tryk, der skal påføres opløsningen med højere opløst koncentration for at forhindre osmose.
2. Kemiske interaktioner: Opløsninger kan interagere med opløsningsmiddelmolekyler gennem forskellige kræfter og ændre solventets egenskaber:
* Hydrogenbinding: Opløsninger, der kan danne brintbindinger med opløsningsmidlet (som vand), kan forstyrre det eksisterende brintbindingsnetværk i opløsningsmidlet og ændre dets egenskaber som viskositet og overfladespænding.
* dipol-dipolinteraktioner: Opløsninger med polære molekyler kan interagere med polære opløsningsmidler, ændre deres dielektriske konstant og påvirke deres evne til at opløse andre opløste stoffer.
* ioniske interaktioner: Opløsninger med ioniske forbindelser kan interagere med polære opløsningsmidler, ændre deres ledningsevne og påvirke deres evne til at opløse andre ioniske forbindelser.
Dette er kun et par eksempler på, hvordan opløste stoffer påvirker opløsningsmiddelegenskaber. Den specifikke effekt afhænger af arten af opløsningsmiddel og opløsningsmiddel såvel som koncentrationen af opløsningen.
Sidste artikelEn lille mængde syre tilsættes til en pufferopløsning, som pH vil?
Næste artikelUdseendet af faste metaller kan beskrives som?
 Varme artikler
Varme artikler
-
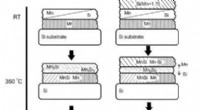 Fysikere overvåger dannelsen af film med højere mangansilicidSkematisk illustration af synteseproceduren til venstre:Mn17Si30 og højre Mn4Si7 -prøve. Kredit:Ivan Tarasov Et team fra Kirensky Institute of Physics (Siberian Branch of the Russian Academy of Sc
Fysikere overvåger dannelsen af film med højere mangansilicidSkematisk illustration af synteseproceduren til venstre:Mn17Si30 og højre Mn4Si7 -prøve. Kredit:Ivan Tarasov Et team fra Kirensky Institute of Physics (Siberian Branch of the Russian Academy of Sc -
 Ingeniører producerer langvarig, energitæthed batteriEt kig inde i energitætheden mangandioxid-zinkbatteri udviklet på CCNY. Kredit:City College i New York En ny generation af mangandioxid-zinkbatterier med hidtil uset cyklusliv og energitæthed er d
Ingeniører producerer langvarig, energitæthed batteriEt kig inde i energitætheden mangandioxid-zinkbatteri udviklet på CCNY. Kredit:City College i New York En ny generation af mangandioxid-zinkbatterier med hidtil uset cyklusliv og energitæthed er d -
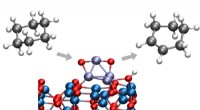 Forskere er banebrydende for den nye kemiske konverteringsproces ved lav temperaturArgonne -kemikere har identificeret en måde at konvertere cyclohexan til cyclohexen eller cyclohexadien, begge vigtige kemikalier i en lang række industrielle processer. Den nye proces finder sted ved
Forskere er banebrydende for den nye kemiske konverteringsproces ved lav temperaturArgonne -kemikere har identificeret en måde at konvertere cyclohexan til cyclohexen eller cyclohexadien, begge vigtige kemikalier i en lang række industrielle processer. Den nye proces finder sted ved -
 Fryseramme:Forskere løser, hvordan celler folder proteiner udKredit:CC0 Public Domain En glad celle er en balanceret celle, men for hvert fantastisk snoet protein, det skaber, den skal rive de gamle i stykker. Det betyder at udrede en indviklet kringleligne
Fryseramme:Forskere løser, hvordan celler folder proteiner udKredit:CC0 Public Domain En glad celle er en balanceret celle, men for hvert fantastisk snoet protein, det skaber, den skal rive de gamle i stykker. Det betyder at udrede en indviklet kringleligne
- Fejl i titreringsforsøg
- Forskere undgår Heisenberg -usikkerhedsprincippet
- Hvad er de vigtigste værktøjer inden for videnskab?
- Ny guide tilbyder støtte og rådgivning til forskere, der oplever online chikane
- Husholdningsgenstande, der bruger magneter
- Hvilken udsagn beskriver ikke nøjagtigt naturlig udvælgelse?


