Hvorfor har hydrogenatomer i vand en let positiv ladning?
Her er en sammenbrud:
* ilt er mere elektronegativ end brint. Dette betyder, at ilt har et stærkere træk på delte elektroner i de kovalente bindinger, den danner med brint.
* ulig deling af elektroner: Som et resultat tilbringer de delte elektroner mere tid tættere på iltatomet, hvilket giver ilt en lidt negativ ladning (Δ-) og forlader brintatomerne med en lidt positiv ladning (Δ+).
* polært molekyle: Denne ujævne fordeling af ladning gør vandmolekylet polar , hvilket betyder, at det har en positiv og negativ ende.
Strukturen af vandmolekylet bidrager yderligere til denne polaritet:
* bøjet form: De to hydrogenatomer er bundet til iltatomet i en vinkel på ca. 104,5 grader, hvilket giver vandmolekylet en bøjet eller V-formet geometri. Denne form styrker den ujævne fordeling af ladning og placerer de positive ladninger på den ene side af molekylet og den negative ladning på den anden.
Denne lille positive ladning på brintatomerne i vand er vigtig for mange biologiske processer, herunder:
* Hydrogenbinding: De positive hydrogenatomer kan danne hydrogenbindinger med andre elektronegative atomer, som ilt eller nitrogen, i andre molekyler. Denne binding er afgørende for at holde store biomolekyler som proteiner og DNA.
* opløselighed: Den polære natur af vand giver den mulighed for at opløse mange polære og ioniske stoffer, hvilket gør det til et fremragende opløsningsmiddel til biologiske processer.
Fortæl mig, hvis du har flere spørgsmål!
Sidste artikelAtomer af et rent stof holdes sammen af?
Næste artikelHvad er eksempler på kulstof arrangeret i et krystalgitter?
 Varme artikler
Varme artikler
-
 Forskere forudser nye superhårde materialerKredit:Pixabay/CC0 Public Domain En gruppe Skoltech -forskere brugte machine learning (ML) metoder til at forudsige superhårde materialer baseret på deres krystalstruktur. Forskningen blev offent
Forskere forudser nye superhårde materialerKredit:Pixabay/CC0 Public Domain En gruppe Skoltech -forskere brugte machine learning (ML) metoder til at forudsige superhårde materialer baseret på deres krystalstruktur. Forskningen blev offent -
 Supercomputering af kemiske reaktionerAnimation, der viser den laveste energiovergangstilstand for dannelsen af cyclopentenoner, som findes i et stort antal naturlige produkter, herunder jasminolier, aflatoksiner, og flere prostaglandin
Supercomputering af kemiske reaktionerAnimation, der viser den laveste energiovergangstilstand for dannelsen af cyclopentenoner, som findes i et stort antal naturlige produkter, herunder jasminolier, aflatoksiner, og flere prostaglandin -
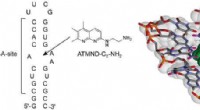 Den tætteste ikke-aminoglykosidligand til det bakterielle ribosomale RNA A-stedKemisk struktur af ATMND-C 2 -NH 2 og sekvensen af den bakterielle (Escherichia coli) A-sted-holdige RNA-model anvendt i denne undersøgelse. Det viser også den mulige struktur af komplekset mell
Den tætteste ikke-aminoglykosidligand til det bakterielle ribosomale RNA A-stedKemisk struktur af ATMND-C 2 -NH 2 og sekvensen af den bakterielle (Escherichia coli) A-sted-holdige RNA-model anvendt i denne undersøgelse. Det viser også den mulige struktur af komplekset mell -
 Alkoholer udviser kvanteeffekterKredit:Skolkovo Institut for Videnskab og Teknologi Skoltech-forskere og deres kolleger fra det russiske kvantecenter afslørede en væsentlig rolle af nukleare kvanteeffekter i polariseringen af
Alkoholer udviser kvanteeffekterKredit:Skolkovo Institut for Videnskab og Teknologi Skoltech-forskere og deres kolleger fra det russiske kvantecenter afslørede en væsentlig rolle af nukleare kvanteeffekter i polariseringen af
- Kostbegrænsning og levetid hos mandlige og hermafrodite orme
- Hvad er cylindriske prøver af havsediment?
- Kun strukturer involveret i mitose-dyreceller?
- To sider af DNA -stigen er løst bundet sammen af hvad?
- Hvorfor har månen store temperaturændringer, mens jorden ikke doserer?
- Hvorfor rige lande og virksomheder skal gøre mere for at rydde op i global giftig kemisk forurening


