Præcis hvilke elementer danner flere ioner?
Her er en sammenbrud:
* Oxidationstilstand: En oxidationstilstand (eller oxidationsnummer) repræsenterer den hypotetiske ladning, som et atom ville have, hvis alle dens bindinger var 100% ioniske.
* ioner: Ioner er atomer eller molekyler, der har opnået eller mistet elektroner, hvilket resulterer i en nettopositive eller negative ladning.
elementer, der udviser flere oxidationstilstande, er primært dem, der findes i overgangsmetaller (grupper 3-12) og ikke-metaller, især dem i grupper 14-17.
Hvorfor har disse elementer flere oxidationstilstande?
* Elektronkonfiguration: Disse elementer har ofte delvist fyldt D- eller P -orbitaler i deres ydre skal, hvilket giver dem mulighed for at miste eller få varierende antal elektroner.
* Kemisk miljø: Den specifikke oxidationstilstand, som et element vedtager, afhænger af de andre atomer, den er bundet til, og det samlede kemiske miljø.
for eksempel:
* jern (Fe): Kan have oxidationstilstande på +2 (Fe²⁺) og +3 (Fe³⁺).
* kobber (CU): Kan have oxidationstilstande på +1 (Cu⁺) og +2 (Cu²⁺).
* klor (Cl): Kan have oxidationstilstande på -1 (cl⁻), +1 (cl⁺), +3 (cl³⁺), +5 (cl⁵⁺) og +7 (cl⁷⁺).
Det er vigtigt at huske:
* Dannelsen af specifikke ioner afhænger af den kemiske reaktion, der finder sted.
* Ikke alle elementer udviser flere oxidationstilstande. For eksempel har alkalimetaller (gruppe 1) typisk en +1 oxidationstilstand, mens alkaliske jordmetaller (gruppe 2) typisk har en +2 oxidationstilstand.
Fortæl mig, hvis du gerne vil have flere detaljer om specifikke elementer og deres almindelige oxidationstilstande!
Sidste artikelHvad er molekylvægten af motorolie?
Næste artikelHvordan er fotosyntesen og kulstofrelateret?
 Varme artikler
Varme artikler
-
 Ionisk defekt landskab i perovskit solceller afsløretKunstnerisk repræsentation af et ionisk defektlandskab i perovskitterne. Kredit:Prof. Dr. Yana Vaynzof (TU Dresden/cfaed) Gruppen af såkaldte metalhalogenidperovskitter som materialer har revolu
Ionisk defekt landskab i perovskit solceller afsløretKunstnerisk repræsentation af et ionisk defektlandskab i perovskitterne. Kredit:Prof. Dr. Yana Vaynzof (TU Dresden/cfaed) Gruppen af såkaldte metalhalogenidperovskitter som materialer har revolu -
 Team sikrer stabilitet af afsaltningsprocessen med magnesiumForsker Hye-Won Kim tilføjer magnesium til havvand for at hæmme tilsmudsning af afsaltningsmembraner. Kredit:Korea Institute of Science and Technology (KIST) Et koreansk forskerhold fandt en metod
Team sikrer stabilitet af afsaltningsprocessen med magnesiumForsker Hye-Won Kim tilføjer magnesium til havvand for at hæmme tilsmudsning af afsaltningsmembraner. Kredit:Korea Institute of Science and Technology (KIST) Et koreansk forskerhold fandt en metod -
 Bæredygtigt læder, garn og papir – fra brødspisende svampeSvampefibre kan omdannes til garn (venstre) eller en lædererstatning (højre). Kredit:Akram Zamani Din næste trendy håndtaske kunne være lavet af læder lavet af en svamp. I dag vil forskere beskrive
Bæredygtigt læder, garn og papir – fra brødspisende svampeSvampefibre kan omdannes til garn (venstre) eller en lædererstatning (højre). Kredit:Akram Zamani Din næste trendy håndtaske kunne være lavet af læder lavet af en svamp. I dag vil forskere beskrive -
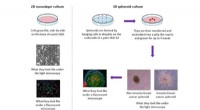 Ny indsigt i, hvordan stamceller interagerer med brystkræftceller2-D in vitro model vs 3-D in vitro model. Kredit:Dr. Morris. En Loughborough University Ph.D. studerende har givet ny indsigt i, hvordan brystkræftceller interagerer med celler i vores krop ved hj
Ny indsigt i, hvordan stamceller interagerer med brystkræftceller2-D in vitro model vs 3-D in vitro model. Kredit:Dr. Morris. En Loughborough University Ph.D. studerende har givet ny indsigt i, hvordan brystkræftceller interagerer med celler i vores krop ved hj
- Hvad skete der med Apollo goodwill måneklipperne?
- Antropologer bekræfter eksistensen af en specialiseret fårejagtlejr i det forhistoriske Libanon
- Er Vantablack virkelig den sorteste sorte?
- 22, 000 år gammel panda fra hule i det sydlige Kina tilhører forskellige, for længst tabt slægt
- Fornyeligt Vs. Nonrenewable Energy Resources
- Forskere indser effektiv hydrogenperoxidproduktion i syre


