Hvorfor troede John Dalton, at elementer er lavet af enkeltatomer?
1. Lov om bevarelse af masse: Dalton observerede, at i kemiske reaktioner er reaktanternes samlede masse altid lig med den samlede masse af produkterne. Dette fik ham til at tro, at sagen ikke blev ødelagt eller skabt, men snarere omarrangeret. Han begrundede, at dette kunne forklares, hvis stof var sammensat af små, udelelige partikler (atomer).
2. Lov om bestemte proportioner: Dalton observerede også, at kemiske forbindelser altid indeholder de samme elementer i de samme proportioner efter masse. For eksempel indeholder vand altid 11,1% brint og 88,9% ilt efter masse, uanset dets kilde. Han forklarede dette ved at antyde, at forbindelser dannes af kombinationen af specifikt antal atomer i hvert element.
3. Lov om flere proportioner: Denne lov siger, at når to elementer danner mere end en forbindelse, er masserne af det ene element, der kombineres med en fast masse af det andet element, i forhold mellem små hele tal. For eksempel kan carbon og ilt danne både carbonmonoxid (CO) og kuldioxid (CO2). Forholdet mellem ilt i disse to forbindelser er 1:2. Dette forstærkede yderligere Daltons idé om, at forbindelser blev dannet af kombinationen af atomer i faste forhold.
4. Enkelhed og elegance: Daltons teori var bemærkelsesværdigt enkel og elegant. Det gav en samlende forklaring på en række kemiske observationer, der tidligere var blevet forbundet. Denne enkelhed gjorde det tiltalende for forskere på det tidspunkt og bidrog til dens udbredte accept.
Det er vigtigt at bemærke, at Daltons teori ikke var uden mangler. Det redegjorde ikke for eksistensen af subatomære partikler, og det antog forkert, at atomer var udelelige. Imidlertid lagde hans teori grundlaget for moderne atomteori, og hans ideer om arten af atomer revolutionerede vores forståelse af stof.
 Varme artikler
Varme artikler
-
 Modermælk som medicinafgivelsesanordningKredit:CC0 Public Domain At behandle syge babyer med modermælk kan en dag blive en realitet, ifølge en artikel i Kemi- og ingeniørnyheder (C&EN), det ugentlige nyhedsmagasin fra American Chemica
Modermælk som medicinafgivelsesanordningKredit:CC0 Public Domain At behandle syge babyer med modermælk kan en dag blive en realitet, ifølge en artikel i Kemi- og ingeniørnyheder (C&EN), det ugentlige nyhedsmagasin fra American Chemica -
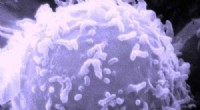 Patientkræftceller vokser pålideligt på nyt 3D-stillads, viser løfte om præcisionsmedicinElektronmikroskopisk billede af en enkelt human lymfocyt. Kredit:Dr. Triche National Cancer Institute En ny 3D-struktur til voksende cellekulturer kan gøre det muligt for læger at teste medicin på
Patientkræftceller vokser pålideligt på nyt 3D-stillads, viser løfte om præcisionsmedicinElektronmikroskopisk billede af en enkelt human lymfocyt. Kredit:Dr. Triche National Cancer Institute En ny 3D-struktur til voksende cellekulturer kan gøre det muligt for læger at teste medicin på -
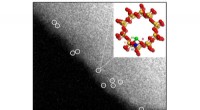 En måde at omdanne metan direkte til methanol eller eddikesyre under milde forholdAberrationskorrigerede HAADF/STEM-billeder af asyntetiseret Rh-ZSM-5. Enkelt rhodiumkationer er omkranset i hvidt med foreslået bold-stick-model af strukturen. Kredit:Lawrence F. Allard, medforfatter
En måde at omdanne metan direkte til methanol eller eddikesyre under milde forholdAberrationskorrigerede HAADF/STEM-billeder af asyntetiseret Rh-ZSM-5. Enkelt rhodiumkationer er omkranset i hvidt med foreslået bold-stick-model af strukturen. Kredit:Lawrence F. Allard, medforfatter -
 Forskningssamarbejde kunne omforme sprøjtestøbningAlicyn Rhoades, adjunkt i teknik ved Penn State Behrend, arbejder på et flash -differentialscanningskalorimeter (Flash DSC). Kredit:Robb Frederick / Penn State Behrend Mens Ralph Colby kigger på m
Forskningssamarbejde kunne omforme sprøjtestøbningAlicyn Rhoades, adjunkt i teknik ved Penn State Behrend, arbejder på et flash -differentialscanningskalorimeter (Flash DSC). Kredit:Robb Frederick / Penn State Behrend Mens Ralph Colby kigger på m
- Dårlig dræning i slumkvarterer og flygtningelejre kan være dødelig - vi skal gøre det bedre
- Jordens første eksempel på genbrug - sin egen skorpe
- Hvad er de andre subatomare partikler, der udgør magnesiumatomet udover protoner og elektroner?
- Hvilke atomer findes i alle makromolekyler?
- Organiske forbindelser viser lovende som billigere alternativer til metalfotokatalysatorer
- Sådan fungerer naturligt udvalg


