Hvorfor har saltvand mere ledningsevne end ledningsvand?
* elektrolytter og ledningsevne: Konduktivitet i en løsning bestemmes af dens evne til at udføre elektricitet. Denne evne er direkte relateret til tilstedeværelsen af frit bevægende ladede partikler kaldet ioner. Løsninger, der udfører elektricitet godt kaldes elektrolytter.
* salt dissociation: Når salt (natriumchlorid, NaCl) opløses i vand, adskiller det sig i dets bestanddele:natriumioner (Na+) og chloridioner (Cl-). Disse ioner er frie til at bevæge sig gennem opløsningen.
* opladningsbærere: Disse frit bevægende ioner fungerer som ladningsfartsselskaber, hvilket giver elektricitet mulighed for at flyde gennem opløsningen. Jo flere ioner til stede, jo bedre ledningsevne.
* TAF VAND: Vandhanen indeholder en lille mængde opløste mineraler, inklusive ioner, men koncentrationen er meget lavere end i saltvand. Dette betyder, at ledningsvand har en lavere koncentration af ladningsbærere og derfor en lavere ledningsevne.
Kortfattet: Saltvand har flere opløste ioner, der fungerer som ladningsbærere, hvilket fører til en meget højere ledningsevne sammenlignet med ledningsvand.
 Varme artikler
Varme artikler
-
 Samling af komplekse molekylerNukleosider er grundlæggende byggesten i genetisk materiale, hvilket gør dem attraktive til en række biologisk relevante anvendelser og som potentielle lægemidler. På City College i New York, forskere
Samling af komplekse molekylerNukleosider er grundlæggende byggesten i genetisk materiale, hvilket gør dem attraktive til en række biologisk relevante anvendelser og som potentielle lægemidler. På City College i New York, forskere -
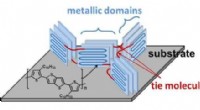 Uvridende plastik til opladning af Internet-of-Things-enhederTil venstre:Forskerne fandt ud af, at deres dopingteknik dannede bindinger (røde) mellem PBTTTs krystallinske dele (blå rektangler). Til højre:De fandt også ud af, at PBTTT var snoet i sin naturlige t
Uvridende plastik til opladning af Internet-of-Things-enhederTil venstre:Forskerne fandt ud af, at deres dopingteknik dannede bindinger (røde) mellem PBTTTs krystallinske dele (blå rektangler). Til højre:De fandt også ud af, at PBTTT var snoet i sin naturlige t -
 Video:Hvordan babyaspirin redder livKredit:The American Chemical Society Lav-dosis baby aspirin gives sjældent til børn længere. I stedet, mennesker med risiko for et hjerteanfald kan tage en daglig aspirin for at mindske deres ris
Video:Hvordan babyaspirin redder livKredit:The American Chemical Society Lav-dosis baby aspirin gives sjældent til børn længere. I stedet, mennesker med risiko for et hjerteanfald kan tage en daglig aspirin for at mindske deres ris -
 Muslinger inspirerer til ny teknologi, der kan hjælpe med at rense vand og rense oliespildKredit:CC0 Public Domain Muslinger er berygtede maritime blindpassagerer kendt for at beskadige bådenes skrog, men de samme klæbeegenskaber har udbredte tekniske anvendelser, Det skriver videnskab
Muslinger inspirerer til ny teknologi, der kan hjælpe med at rense vand og rense oliespildKredit:CC0 Public Domain Muslinger er berygtede maritime blindpassagerer kendt for at beskadige bådenes skrog, men de samme klæbeegenskaber har udbredte tekniske anvendelser, Det skriver videnskab


