Hvad er ladningen på ion, der typisk dannes af hvert element?
gruppe 1 (alkalimetaller):+1
* Eksempel: Natrium (na⁺), kalium (k⁺)
* Årsag: Alkalimetaller har en valenselektron (elektron i den yderste skal). De mister let dette elektron for at opnå en stabil oktet (8 elektroner) i deres yderste skal og danner en +1 ladning.
gruppe 2 (alkaliske jordmetaller):+2
* Eksempel: Calcium (Ca²⁺), magnesium (mg²⁺)
* Årsag: Alkaliske jordmetaller har to valenselektroner. De mister begge for at opnå en stabil octet, hvilket resulterer i en +2 ladning.
gruppe 13 (borgruppe):+3
* Eksempel: Aluminium (al³⁺)
* Årsag: Borongruppelementer har tre valenselektroner. De har en tendens til at miste disse for at opnå en stabil octet og danner en +3 ladning. Nogle elementer i denne gruppe kan imidlertid også danne andre anklager.
gruppe 14 (Carbon Group):Variabel
* Eksempel: Carbon (c⁴⁺, c⁴⁻), silicium (si⁴⁺, si⁴⁻)
* Årsag: Elementer i denne gruppe har fire valenselektroner. De kan enten vinde eller miste elektroner for at opnå en stabil oktet, hvilket resulterer i variable afgifter.
gruppe 15 (nitrogengruppe):-3
* Eksempel: Nitrogen (n³⁻), fosfor (p³⁻)
* Årsag: Elementer i denne gruppe har fem valenselektroner. De har en tendens til at få tre elektroner for at opnå en stabil oktet, hvilket resulterer i en -3 -ladning.
gruppe 16 (iltgruppe):-2
* Eksempel: Ilt (o²⁻), svovl (s²⁻)
* Årsag: Elementer i denne gruppe har seks valenselektroner. De har en tendens til at få to elektroner for at opnå en stabil oktet, hvilket resulterer i en -2 -ladning.
gruppe 17 (halogener):-1
* Eksempel: Klor (cl⁻), brom (br⁻)
* Årsag: Halogener har syv valenselektroner. De får en elektron for at opnå en stabil oktet, hvilket resulterer i en -1 -ladning.
gruppe 18 (ædelgasser):normalt 0
* Eksempel: Helium (He), Neon (NE), Argon (AR)
* Årsag: Noble gasser har allerede en fuld ydre skal af elektroner (stabil oktet), så de danner sjældent ioner.
Overgangsmetaller:Variabel
* Eksempel: Jern (fe²⁺, fe³⁺), kobber (cu⁺, cu²⁺)
* Årsag: Overgangsmetaller har varierende antal valenselektroner og kan miste forskellige antal elektroner til dannelse af ioner med flere ladninger.
Vigtige noter:
* Undtagelser: Der er undtagelser fra disse generelle tendenser. For eksempel kan bly (PB) danne både +2 og +4 ioner, og nogle overgangsmetaller kan danne ioner med uventede afgifter.
* polyatomiske ioner: Mange ioner er sammensat af mere end et atom, kendt som polyatomiske ioner. De har en specifik samlet afgift. Eksempler inkluderer sulfat (SO₄²⁻), nitrat (NO₃⁻) og phosphat (Po₄³⁻).
Jeg håber, at denne forklaring er nyttig!
 Varme artikler
Varme artikler
-
 Forskere udvikler billige, høj strømtæthed vanadium flow batteri stakNy generation af vanadiumflow-batteristabelteknologi tilbyder lave omkostninger og høj effekttæthed. Kredit:SHI Dingqin Udviklingen af vedvarende energikilder såsom vind- og solenergi er begræns
Forskere udvikler billige, høj strømtæthed vanadium flow batteri stakNy generation af vanadiumflow-batteristabelteknologi tilbyder lave omkostninger og høj effekttæthed. Kredit:SHI Dingqin Udviklingen af vedvarende energikilder såsom vind- og solenergi er begræns -
 Forskere opdager en ny fase i blokcopolymererKunstnerens koncept, der skildrer blokpolymerer pakket sammen til dannelse, I dette tilfælde, en ny fase af diblok-copolymer. Kredit:Brian Long Alt stof består af en eller flere faser - områder af
Forskere opdager en ny fase i blokcopolymererKunstnerens koncept, der skildrer blokpolymerer pakket sammen til dannelse, I dette tilfælde, en ny fase af diblok-copolymer. Kredit:Brian Long Alt stof består af en eller flere faser - områder af -
 Banebrydende materiale kan føre til billigere, mere udbredte solpaneler og elektronikKredit:University of Kansas Forestil dig at udskrive elektroniske enheder ved hjælp af en simpel inkjet-printer - eller endda male et solpanel på væggen i en bygning. En sådan teknologi ville red
Banebrydende materiale kan føre til billigere, mere udbredte solpaneler og elektronikKredit:University of Kansas Forestil dig at udskrive elektroniske enheder ved hjælp af en simpel inkjet-printer - eller endda male et solpanel på væggen i en bygning. En sådan teknologi ville red -
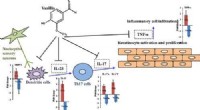 Forebyggelse af psoriasis med vanillinKredit:American Chemical Society Små mængder kunstig vaniljeekstrakt, også kendt som vanillin, findes i en bred vifte af produkter, fra bagværk til parfume. Men vanillins alsidighed stopper ikke d
Forebyggelse af psoriasis med vanillinKredit:American Chemical Society Små mængder kunstig vaniljeekstrakt, også kendt som vanillin, findes i en bred vifte af produkter, fra bagværk til parfume. Men vanillins alsidighed stopper ikke d
- Forskerteam låser op for ny metode til 3D-print af komplekse, funktionelle komponenter til blød ro…
- Sådan finder du en anden linje
- Hvor stabil er den vestantarktiske iskappe?
- Hvorfor er der ikke noget land på Jupiter?
- Hvorfor gør få store planter under nåletræer?
- Hvilke celler produceret ved fusion af monocytter?


