Hvad er tin som en stabil elektronkonfiguration?
Elektronkonfiguration:
* 1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D¹⁰ 4P⁶ 5S² 4D¹⁰ 5p²
Forklaring:
* 1S²: Det første energiniveau (n =1) har to elektroner i 1'erne orbital.
* 2s² 2p⁶: Det andet energiniveau (n =2) har to elektroner i 2'erne orbital og seks elektroner i 2p -orbitaler.
* 3s² 3p⁶: Det tredje energiniveau (n =3) har to elektroner i 3'erne orbital og seks elektroner i 3p -orbitaler.
* 4S² 3D¹⁰: Det fjerde energiniveau (n =4) har to elektroner i 4S -orbitalen og ti elektroner i 3D -orbitaler. Bemærk, at 3D -orbitalerne udfyldes efter 4S -orbitalen.
* 4p⁶: Det fjerde energiniveau (n =4) har seks elektroner i 4p orbitaler.
* 5s² 4d¹⁰: Det femte energiniveau (n =5) har to elektroner i 5'erne orbital og ti elektroner i 4D -orbitaler.
* 5p²: Det femte energiniveau (n =5) har to elektroner i 5p -orbitaler.
stabil konfiguration:
Elektronkonfigurationen af tin betragtes som stabil, fordi dens ydre skal (5p) indeholder to elektroner, som er halvfyldt. Mens en fuld skal af otte elektroner er ideel, er en halvfyldt skal også relativt stabil på grund af dens afbalancerede fordeling af elektroner.
Vigtig note: Tin kan eksistere i to allotropiske former:hvid tin og grå tin. Elektronkonfigurationen ovenfor er til hvid tin, den mest almindelige form. Grå tin har en lidt anden elektronisk struktur på grund af dens forskellige krystalgitter.
 Varme artikler
Varme artikler
-
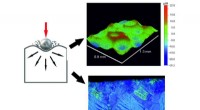 De seneste magnesiumundersøgelser baner vejen for nye biomedicinske materialerOverflademekanisk slidbehandling (SMAT) af magnesium forbedrer dets styrke og korrosionsbestandighed. Kredit:IFJ PAN Materialer anvendt i biomedicin skal karakteriseres ved kontrolleret bionedbryd
De seneste magnesiumundersøgelser baner vejen for nye biomedicinske materialerOverflademekanisk slidbehandling (SMAT) af magnesium forbedrer dets styrke og korrosionsbestandighed. Kredit:IFJ PAN Materialer anvendt i biomedicin skal karakteriseres ved kontrolleret bionedbryd -
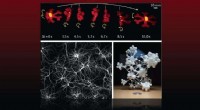 Forskere kortlægger fremskridt inden for arkitektonerede materialer, der reagerer på ydre stimuliI papir udgivet af Nature Reviews Materials , Lawrence Livermore National Laboratory-forskere giver et overblik over de fremskridt, der er gjort inden for responsive arkitektonerede materialer, der ka
Forskere kortlægger fremskridt inden for arkitektonerede materialer, der reagerer på ydre stimuliI papir udgivet af Nature Reviews Materials , Lawrence Livermore National Laboratory-forskere giver et overblik over de fremskridt, der er gjort inden for responsive arkitektonerede materialer, der ka -
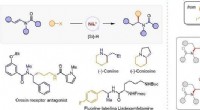 Kirale aminer syntetiseret ved nikkelkatalyseret asymmetrisk reduktiv hydroalkyleringSyntese af chirale alifatiske aminer ved reduktiv hydroalkylering af enamider. Kredit:WANG Jiawang For nylig, en forskergruppe ledet af prof. Fu Yao og associeret forsker Lu Xi fra Hefei National
Kirale aminer syntetiseret ved nikkelkatalyseret asymmetrisk reduktiv hydroalkyleringSyntese af chirale alifatiske aminer ved reduktiv hydroalkylering af enamider. Kredit:WANG Jiawang For nylig, en forskergruppe ledet af prof. Fu Yao og associeret forsker Lu Xi fra Hefei National -
 Fra gerningsstedet til retssalen - en DNA -prøves rejsePolitiet skal sikre, at prøver ikke er forurenet. Kredit:James Hereward og Caitlin Curtis, Forfatter angivet O.J. Simpson-mordssagen i 1995 introducerede DNA-kriminalteknik for offentligheden. Sag
Fra gerningsstedet til retssalen - en DNA -prøves rejsePolitiet skal sikre, at prøver ikke er forurenet. Kredit:James Hereward og Caitlin Curtis, Forfatter angivet O.J. Simpson-mordssagen i 1995 introducerede DNA-kriminalteknik for offentligheden. Sag
- Andet derefter solen, der er nærmest stjerne på Jorden?
- Finjustering af magnetisk spin for hurtigere, mindre hukommelsesenheder
- Hvad er en afbalanceret kemisk ligning, hvorfor skal den være afbalanceret?
- Hvilke mineraler er forbundet med den højre gren af reaktionsserien?
- Sådan beregnes millimoler til milligrams
- Big data-analyse for dummies


