Hvad er væsker faste gasser og plasmaer?
1. Faste stoffer
* Karakteristika:
* Bestemt form og volumen.
* Molekyler er tæt pakket og arrangeret i et regelmæssigt, gentagende mønster (krystallinsk struktur).
* Vibrer i faste positioner, men flyt ikke frit.
* Ukomprimerbar (vanskeligt at ændre deres volumen).
* Eksempler: Klipper, is, træ, stål
2. Væsker
* Karakteristika:
* Bestemt volumen, men tag formen på deres beholder.
* Molekyler er tæt sammen, men kan bevæge sig rundt om hinanden (væske).
* Ukomprimerbar (vanskeligt at ændre deres volumen).
* Eksempler: Vand, juice, olie, kviksølv
3. Gasser
* Karakteristika:
* Ingen bestemt form eller volumen.
* Molekyler er langt fra hinanden og bevæger sig frit og tilfældigt.
* Meget komprimerbar (skift let deres volumen).
* Eksempler: Luft, ilt, nitrogen, kuldioxid
4. Plasmaer
* Karakteristika:
* Ligner gasser, men med en betydelig del af deres atomer ioniseret (atomer med en positiv eller negativ ladning).
* Meget ledende for elektricitet og magnetiske felter.
* Eksempler: Solen, lynet, neonskilte, fluorescerende lys
Her er en nyttig analogi:
Tænk på molekylerne i hver stat som en gruppe mennesker:
* faste stoffer: Folk pakket tæt på en linje på en koncert, vibrerer på plads, men bevæger sig ikke meget.
* væsker: Folk overfyldte i et rum, stødte på hinanden, men i stand til at bevæge sig frit.
* Gasser: Folk spredte sig ud i et stort felt, i stand til at bevæge sig frit og kolliderer tilfældigt.
* plasma: Mennesker i en mængde, hvor mange har mistet deres sko og danser vildt og skaber et energisk og uforudsigeligt miljø.
Nøgleforskelle:
* afstand mellem molekyler: Faststoffer har den nærmeste afstand, efterfulgt af væsker, derefter gasser og til sidst plasmaer.
* Bevægelse: Molekyler i faste stoffer har mindst bevægelse, efterfulgt af væsker, derefter gasser og til sidst plasmaer.
* Energi: Jo højere temperatur er, jo mere energi har molekylerne, hvilket kan føre til en ændring i tilstand. For eksempel forvandler opvarmning af is (fast) det til vand (væske).
 Varme artikler
Varme artikler
-
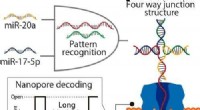 Nanopore-teknologi med DNA-beregning registrerer let mikroRNA-mønstre af lungekræftDNAer genkendte autonomt to mikroRNAer, miR-20a og miR-17-5p, og dannede en fire-vejs forbindelsesstruktur, der blev fanget i nanopore, viser lange blokeringsstrømme. Kredit:Figur tilpasset med tillad
Nanopore-teknologi med DNA-beregning registrerer let mikroRNA-mønstre af lungekræftDNAer genkendte autonomt to mikroRNAer, miR-20a og miR-17-5p, og dannede en fire-vejs forbindelsesstruktur, der blev fanget i nanopore, viser lange blokeringsstrømme. Kredit:Figur tilpasset med tillad -
 Sensoren registrerer lugt af dårlig åndeKredit:American Chemical Society Har du nogensinde ønsket, at du kunne lave et hurtigt åndedrætstjek før et vigtigt møde eller en stor date? Nu forskere, rapportering i ACS journal Analytisk kemi
Sensoren registrerer lugt af dårlig åndeKredit:American Chemical Society Har du nogensinde ønsket, at du kunne lave et hurtigt åndedrætstjek før et vigtigt møde eller en stor date? Nu forskere, rapportering i ACS journal Analytisk kemi -
 Tweaks bag genfødslen af næsten kasserede organiske solteknologierUdvælgelse af solceller i laboratoriet hos GTRI Principal Research Engineer Jud Ready. Cellerne inkluderer 3D, CZTS, organisk solcelle, og silicium. Kredit:Georgia Tech/Branden Camp Et solenergima
Tweaks bag genfødslen af næsten kasserede organiske solteknologierUdvælgelse af solceller i laboratoriet hos GTRI Principal Research Engineer Jud Ready. Cellerne inkluderer 3D, CZTS, organisk solcelle, og silicium. Kredit:Georgia Tech/Branden Camp Et solenergima -
 Minitraktorbjælker hjælper med at arrangere kunstige celler i vævsstrukturerKunstige celler (billede i falske farver) i en række strukturer. Kredit:Imperial College London Forskere har brugt lasere til at forbinde, arrangere og flette kunstige celler, baner vejen for netv
Minitraktorbjælker hjælper med at arrangere kunstige celler i vævsstrukturerKunstige celler (billede i falske farver) i en række strukturer. Kredit:Imperial College London Forskere har brugt lasere til at forbinde, arrangere og flette kunstige celler, baner vejen for netv
- hvad er bidekraften af en smilodon i psi?
- Amazon Go -direktører deler indsigt i indkøbsadfærd
- Kendskab til alvorlige stormmønstre kan forbedre tornado-advarsler
- Hvordan man vælger den rigtige leder ved at slippe af med vores kognitive skævheder
- USA's ørkenområder bliver endnu mere tørre
- Sådan beregnes en rabat på 10 procent


