Hvordan beskrives elementer i form af atomer?
1. Atomnummer:
- Det definerende kendetegn ved et element er dets atomnummer , der repræsenterer antallet af protoner i kernen i et atom.
- Alle atomer med det samme element har det samme atomnummer.
- For eksempel har alle carbonatomer et atomnummer på 6, hvilket betyder, at de har 6 protoner i deres kerne.
2. Atommasse:
- Atommassen atommasse af et element er den gennemsnitlige masse af alle dets naturligt forekommende isotoper.
- Isotoper er atomer med det samme element, der har det samme antal protoner, men adskiller sig i antallet af neutroner.
-For eksempel har carbon to hovedisotoper:carbon-12 (6 protoner, 6 neutroner) og carbon-13 (6 protoner, 7 neutroner). Atommassen af kulstof er cirka 12.011 atommasseenheder (AMU), hvilket afspejler forekomsten af disse isotoper.
3. Elektronkonfiguration:
- elektronkonfiguration Beskriver, hvordan elektroner er arrangeret omkring kernen i et atom.
- Det dikterer de kemiske egenskaber ved et element, da elektronerne i den yderste skal er involveret i kemisk binding.
- Hvert element har en unik elektronkonfiguration.
4. Kemiske egenskaber:
- Elementer er kendetegnet ved deres kemiske egenskaber , der beskriver, hvordan de interagerer med andre elementer og forbindelser.
- Disse egenskaber bestemmes af atomets elektronkonfiguration og dens evne til at vinde, miste eller dele elektroner.
- For eksempel er natrium meget reaktiv, fordi det let mister sin yderste elektron til at danne en positiv ion.
5. Fysiske egenskaber:
- Elementer har også karakteristiske fysiske egenskaber , såsom densitet, smeltepunkt, kogepunkt og farve.
- Disse egenskaber er relateret til atomets størrelse, masse og styrken af kræfterne, der holder atomer sammen.
Kortfattet: Elementer er beskrevet af deres grundlæggende atomegenskaber, der dikterer deres kemiske og fysiske opførsel. At forstå atomet er afgørende for at forstå elementernes art og opførsel.
 Varme artikler
Varme artikler
-
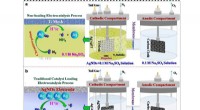 Nyt elektrokatalysesystem realiserer omgivende ammoniakelektrosynteseSkematisk illustration af en. den ikke-belastende NRR-elektrokatalyseproces og b. den traditionelle elektrokatalyseproces, der belaster katalysatoren. Kredit:LI Wenyi Det er almindeligt kendt, at
Nyt elektrokatalysesystem realiserer omgivende ammoniakelektrosynteseSkematisk illustration af en. den ikke-belastende NRR-elektrokatalyseproces og b. den traditionelle elektrokatalyseproces, der belaster katalysatoren. Kredit:LI Wenyi Det er almindeligt kendt, at -
 Forskere opnår termokemiluminescens i fast tilstand med krystallerFaststof termokemiluminescens af krystaller, der udsender lys, når de opvarmes, optaget af NYUAD-forskere. Kredit:Dr. Stefan Schramm Fundene, offentliggjort i tidsskriftet Naturkommunikation , d
Forskere opnår termokemiluminescens i fast tilstand med krystallerFaststof termokemiluminescens af krystaller, der udsender lys, når de opvarmes, optaget af NYUAD-forskere. Kredit:Dr. Stefan Schramm Fundene, offentliggjort i tidsskriftet Naturkommunikation , d -
 Nyt stik til bæredygtige strukturer på jorden og i rummetRomain van Wassenhove med det nye stik. Kredit:Alain Herzog / EPFL 2021 Som en del af sin kandidatgrad i civilingeniør, en EPFL -studerende (Ecole Polytechnique Federale de Lausanne) udviklede et
Nyt stik til bæredygtige strukturer på jorden og i rummetRomain van Wassenhove med det nye stik. Kredit:Alain Herzog / EPFL 2021 Som en del af sin kandidatgrad i civilingeniør, en EPFL -studerende (Ecole Polytechnique Federale de Lausanne) udviklede et -
 Elektronisk affald udvindes for sjældne jordarterOak Ridge National Laboratory’s Ramesh Bhave co-opfandt en proces til genopretning af sjældne jordartselementer med høj renhed fra skrotede magneter af computerharddiske (vist her) og andet affald fra
Elektronisk affald udvindes for sjældne jordarterOak Ridge National Laboratory’s Ramesh Bhave co-opfandt en proces til genopretning af sjældne jordartselementer med høj renhed fra skrotede magneter af computerharddiske (vist her) og andet affald fra
- Gærceller udfører hvilken slags gæring?
- Små bobler knækker kulstofnanorør som kviste
- Hvad er plastopløsningsmiddel?
- Trang til at fusionere:Forstå hvordan celler smelter sammen
- Et 'B12-skud' til marine alger? Forskere finder nøglevækst af proteinalger i havet
- På hvilket sted smelter rock, der giver mulighed for dannelse af Igneuss?


