Hvor mange valenselektron er der behov for, at et atom er stabilt?
Her er en generel regel:
* atomer stræber efter at have 8 valenselektroner (Bortset fra brint og helium, som kun har brug for 2). Dette er kendt som octet -reglen .
for eksempel:
* ilt (O) Har 6 valenselektroner. Det har brug for yderligere 2 elektroner for at afslutte sin ydre skal og opnå stabilitet.
* natrium (NA) har 1 valenselektron. Det vil let miste dette elektron for at opnå en stabil konfiguration med 8 valenselektroner i sin næste nedre skal.
* helium (He) Har 2 valenselektroner, som er det maksimale antal for dets ydre skal. Det er allerede stabilt.
Undtagelser fra Octet -reglen:
* elementer i den tredje række og ud over Kan have mere end 8 valenselektroner på grund af tilgængeligheden af D -orbitaler.
* Nogle atomer kan være stabile med færre end 8 valenselektroner , såsom i tilfælde af bor (B) og beryllium (BE).
At forstå oktetreglen hjælper med at forudsige, hvordan atomer vil binde med hinanden for at opnå stabilitet og danne molekyler.
Sidste artikelHvad er eksempler på opløselige faste stoffer?
Næste artikelHvilke kerner smelter sammen for at danne ilt?
 Varme artikler
Varme artikler
-
 Efter et århundredes søgen, forskere finder ny flydende faseFarverne i denne nyopdagede fase af flydende krystal skifter, mens forskere anvender et lille elektrisk felt. Kredit:SMRC Forskere ved University of Colorado Boulders Soft Materials Research Cente
Efter et århundredes søgen, forskere finder ny flydende faseFarverne i denne nyopdagede fase af flydende krystal skifter, mens forskere anvender et lille elektrisk felt. Kredit:SMRC Forskere ved University of Colorado Boulders Soft Materials Research Cente -
 Alternative cementopskrifter - En opskrift på øko-betonIngredienserne til øko-cement blandes i betonlaboratoriet. Kredit:Empa Det er det mest udbredte produkt i verden. Cement er uundværlig, men dets omdømme er blevet ret plettet i løbet af den igangv
Alternative cementopskrifter - En opskrift på øko-betonIngredienserne til øko-cement blandes i betonlaboratoriet. Kredit:Empa Det er det mest udbredte produkt i verden. Cement er uundværlig, men dets omdømme er blevet ret plettet i løbet af den igangv -
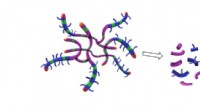 Radikale trin mod ren indkapslingEn polymer, der både kan samle sig til stjerneformede nanopartikler og nedbrydes, når den ikke længere er nødvendig, kan påvirke kemisk indkapslingsteknologi. Kredit:Royal Society of Chemistry En
Radikale trin mod ren indkapslingEn polymer, der både kan samle sig til stjerneformede nanopartikler og nedbrydes, når den ikke længere er nødvendig, kan påvirke kemisk indkapslingsteknologi. Kredit:Royal Society of Chemistry En -
 Comb alkometer er nu tusind gange mere følsom over for sygdomsbiomarkørerKandidatstuderende Qizhong Liang justerer JILAs frekvenskam-alkometer, som identificerer molekyler forbundet med sygdom baseret på farver og mængder af lys absorberet inde i røret (til venstre), der i
Comb alkometer er nu tusind gange mere følsom over for sygdomsbiomarkørerKandidatstuderende Qizhong Liang justerer JILAs frekvenskam-alkometer, som identificerer molekyler forbundet med sygdom baseret på farver og mængder af lys absorberet inde i røret (til venstre), der i


