Hvilket element er mere reaktivt - lithium li eller beryllium være?
Her er hvorfor:
* ioniseringsenergi: Lithium har en lavere ioniseringsenergi end beryllium. Dette betyder, at det kræver mindre energi at fjerne et elektron fra et lithiumatom, hvilket gør det lettere at danne en positiv ion og deltage i kemiske reaktioner.
* Elektropositivitet: Lithium er mere elektropositiv end beryllium. Elektropositivitet henviser til et elements tendens til at miste elektroner og danne positive ioner.
* atomstørrelse: Lithiumatomer er mindre end berylliumatomer. Denne mindre størrelse fører til en stærkere attraktion mellem kernen og valenselektronen, hvilket gør det lettere for lithium at miste sin elektron.
Generelt øges reaktiviteten ned i en gruppe og falder over en periode i den periodiske tabel. Lithium er i gruppe 1 (alkalimetaller), og beryllium er i gruppe 2 (alkaliske jordmetaller). Lithium er højere op i den periodiske tabel end beryllium, så det er mere reaktivt.
 Varme artikler
Varme artikler
-
 Galvanisering:Fødslen af en enkelt kerne fanget i kameraSkematisk af detektering af optisk feedback af de hydrodynamiske signaturer af nukleation. en lodret orienteret probe (VOP) scannet over de begyndende Cu -kerner på ITO -elektroden (grå). Den blå grad
Galvanisering:Fødslen af en enkelt kerne fanget i kameraSkematisk af detektering af optisk feedback af de hydrodynamiske signaturer af nukleation. en lodret orienteret probe (VOP) scannet over de begyndende Cu -kerner på ITO -elektroden (grå). Den blå grad -
 Et omfattende kig på komælkKredit:American Chemical Society Mælk er en fast bestanddel af den menneskelige kost, fuld af vigtige næringsstoffer som protein, kulhydrater, fedtstoffer, og vitaminer. Især komælk er et af de me
Et omfattende kig på komælkKredit:American Chemical Society Mælk er en fast bestanddel af den menneskelige kost, fuld af vigtige næringsstoffer som protein, kulhydrater, fedtstoffer, og vitaminer. Især komælk er et af de me -
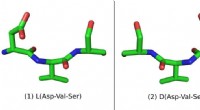 Gennem skueglasset:Nye spejlbillede-molekyler kan føre til bedre medicinDette peptid består af tre aminosyrer:Aspartinsyre (Asp), Valin (Val) og Serine (Ser). Den naturlige L-form er til venstre og den syntetiske D-form er til højre Kredit:Pablo Gainza University of T
Gennem skueglasset:Nye spejlbillede-molekyler kan føre til bedre medicinDette peptid består af tre aminosyrer:Aspartinsyre (Asp), Valin (Val) og Serine (Ser). Den naturlige L-form er til venstre og den syntetiske D-form er til højre Kredit:Pablo Gainza University of T -
 En unik katalysator baner vejen for plast-upcyclingVisuel af to variationer af katalysatoren, med et segment af skallen fjernet for at vise det indre. Den hvide kugle repræsenterer silicaskallen, hullerne er porerne. De lyse grønne kugler repræsentere
En unik katalysator baner vejen for plast-upcyclingVisuel af to variationer af katalysatoren, med et segment af skallen fjernet for at vise det indre. Den hvide kugle repræsenterer silicaskallen, hullerne er porerne. De lyse grønne kugler repræsentere
- Sådan beregner du strømmen af fotoner
- Forskere udvikler sammenfiltrede fotonpar i integreret siliciumcarbid for første gang
- Små klimaændringer kan have ødelæggende lokale konsekvenser - det skete i den lille istid
- Total måneformørkelse:observation af Jorden som en transitplanet
- Hvilken tid på året kan konstellationen jomfru ses?
- Hvor i jorden findes tin?


