Kombinerer atomer af forskellige elementer det samme?
* Unikke egenskaber: Hvert element har et unikt antal protoner (atomnummer), der bestemmer dets kemiske opførsel. Dette betyder, at de har forskellige:
* Elektronkonfigurationer: Hvordan deres elektroner er arrangeret omkring kernen.
* Elektronegativitet: Deres tendens til at tiltrække elektroner i en binding.
* ioniseringsenergi: Den energi, der kræves for at fjerne et elektron.
* reaktivitet: Hvor let de danner obligationer med andre elementer.
* Bindingspræferencer: På grund af disse unikke egenskaber har elementer forskellige præferencer for, hvordan de binder:
* ioniske bindinger: Elementer med store forskelle i elektronegativitet har en tendens til at danne ioniske bindinger, hvor det ene atom mister elektroner (bliver en kation) og de andre får elektroner (bliver en anion).
* kovalente obligationer: Elementer med lignende elektronegativitet deler elektroner til dannelse af kovalente bindinger.
* Metalliske obligationer: Metaller deler elektroner i et "hav" af elektroner, så de kan udføre elektricitet og varme.
Eksempler:
* natrium (NA) og chlor (CL): Natrium har en løst bundet elektron, og chlor har brug for en elektron for at afslutte sin ydre skal. De danner let en ionisk binding, hvilket resulterer i natriumchlorid (NaCI) eller tabel salt.
* carbon (c) og brint (h): Carbon har fire valenselektroner, og brint har en. De deler elektroner til dannelse af kovalente bindinger, hvilket fører til en lang række organiske molekyler som metan (CH4).
Kortfattet: De specifikke måder atomer af forskellige elementer kombinerer afhænger af deres unikke egenskaber og bindingspræferencer. Disse interaktioner giver anledning til den utrolige mangfoldighed af forbindelser og materialer i verden.
 Varme artikler
Varme artikler
-
 Ny enhed identificerer bloddonorer af høj kvalitetKredit:CC0 Public Domain Blodbanker har længe kendt til donorer af høj kvalitet - individer, hvis røde blodlegemer forbliver levedygtige i længere tid i opbevaring og i modtagerens krop. Nu viser
Ny enhed identificerer bloddonorer af høj kvalitetKredit:CC0 Public Domain Blodbanker har længe kendt til donorer af høj kvalitet - individer, hvis røde blodlegemer forbliver levedygtige i længere tid i opbevaring og i modtagerens krop. Nu viser -
 Hurtigere, grønnere måde at producere kulstofkugler påKulissfærer - mikroskopbilleder Hurtig, grøn og et-trins metode til fremstilling af porøse kulstofkugler, som er en vital komponent for kulstoffangstteknologi og for nye måder at lagre vedvarende ener
Hurtigere, grønnere måde at producere kulstofkugler påKulissfærer - mikroskopbilleder Hurtig, grøn og et-trins metode til fremstilling af porøse kulstofkugler, som er en vital komponent for kulstoffangstteknologi og for nye måder at lagre vedvarende ener -
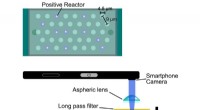 Smartphone virusscanner:Ny bærbar enhed lader smartphones tælle biologiske viraDe virusholdige hulrum er 4,5 mikrometer på tværs og 9 mikrometer fra hinanden. Kredit:Minagawa et al. Den nuværende førende metode til at vurdere tilstedeværelsen af vira og andre biologiske ma
Smartphone virusscanner:Ny bærbar enhed lader smartphones tælle biologiske viraDe virusholdige hulrum er 4,5 mikrometer på tværs og 9 mikrometer fra hinanden. Kredit:Minagawa et al. Den nuværende førende metode til at vurdere tilstedeværelsen af vira og andre biologiske ma -
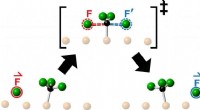 Opdagelsen af knock-on kemi åbner nye grænser inden for reaktionsdynamikEn kunstners fortolkning af den energibarriere, som et reagensfluoratom skal krydse, når det kolliderer med et fluormethylmolekyle på vej til at danne et produkt som følge af en kemisk reaktion. Forsk
Opdagelsen af knock-on kemi åbner nye grænser inden for reaktionsdynamikEn kunstners fortolkning af den energibarriere, som et reagensfluoratom skal krydse, når det kolliderer med et fluormethylmolekyle på vej til at danne et produkt som følge af en kemisk reaktion. Forsk
- Kul og COVID-19:Hvordan pandemien accelererer slutningen af fossil energiproduktion
- Hvad er den gravitationelle potentielle energi for en person på 60 kg, der står på taget 10-etage…
- 5 grunde til, at parasitter er til gavn for jorden
- Hvordan klimaændringer påvirker nitrogenpuljen i uafskallet jord i det nordøstlige Kina
- Signaturtilgang afslører værdsatte egenskaber i nanoskopisk materiale
- Cysteinsyntese var et nøgletrin i livets oprindelse:undersøgelse


