Hvilken har et højere kogepunkt CO2 eller SiO2?
* binding: SiO2 har en netværkskovalent struktur. Dette betyder, at silicium- og iltatomer er forbundet i et kæmpe, tredimensionelt netværk af stærke kovalente bindinger. CO2 er på den anden side et simpelt molekyle med svage intermolekylære kræfter (van der Waals kræfter) mellem molekyler.
* Styrke af obligationer: Kovalente obligationer er meget stærkere end van der Waals -styrker. For at bryde netværket af kovalente bindinger i SiO2 kræves der meget mere energi end for at overvinde de svage intermolekylære kræfter i CO2.
Kogepunkt:
* siO2: 2230 ° C (4028 ° F)
* CO2: -78,5 ° C (-109,3 ° F)
Kort sagt: Den stærke kovalente binding i SiO2 gør det ekstremt vanskeligt at bryde fra hinanden, hvilket fører til dets meget høje kogepunkt. CO2s enkle molekylstruktur og svage intermolekylære kræfter resulterer i et meget lavere kogepunkt.
Sidste artikelHvad betyder fysisk og kemisk inden for videnskab?
Næste artikelHvad er ioner lavet af mere end et atom?
 Varme artikler
Varme artikler
-
 Små mikrodråbe kemiske reaktorer er med til at revolutionere videnskabelige eksperimenterVidenskaben bliver mindre. Fra todimensionelle nye materialer til nano-robotter, mange af de seneste fremskridt bliver gjort i skalaer, som er umulige at se med det menneskelige øje. Den seneste tekn
Små mikrodråbe kemiske reaktorer er med til at revolutionere videnskabelige eksperimenterVidenskaben bliver mindre. Fra todimensionelle nye materialer til nano-robotter, mange af de seneste fremskridt bliver gjort i skalaer, som er umulige at se med det menneskelige øje. Den seneste tekn -
 Skoler med molekylær fisk kunne forbedre skærmeSkoler af solitons form til klynger. Kredit:Smalyukh lab Tag et dyk ned i det, der kan være verdens mindste koralrev. Forskere ved University of Colorado Boulder bruger en type materiale kaldet fl
Skoler med molekylær fisk kunne forbedre skærmeSkoler af solitons form til klynger. Kredit:Smalyukh lab Tag et dyk ned i det, der kan være verdens mindste koralrev. Forskere ved University of Colorado Boulder bruger en type materiale kaldet fl -
 Kanter og hjørner øger effektiviteten af katalysatorerMed stigende ilt (rød) koncentration, der dannes en oxidsandwich på overfladen af de metalliske nanopartikler, inhibering af den ønskede reaktion af carbonmonoxid til carbondioxid. I kanterne, imidl
Kanter og hjørner øger effektiviteten af katalysatorerMed stigende ilt (rød) koncentration, der dannes en oxidsandwich på overfladen af de metalliske nanopartikler, inhibering af den ønskede reaktion af carbonmonoxid til carbondioxid. I kanterne, imidl -
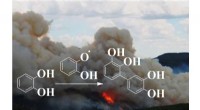 Brunt kulstof fra aromatiske forurenende stoffer udsendes under forbrænding og naturbrandeEn dimeriseringsreaktion af en polyphenol er afbildet til at forløbe ved grænseflader for at bidrage til dannelsen af brunt organisk kulstof under transporten af en røgfane. Kredit:Marcelo Guzman
Brunt kulstof fra aromatiske forurenende stoffer udsendes under forbrænding og naturbrandeEn dimeriseringsreaktion af en polyphenol er afbildet til at forløbe ved grænseflader for at bidrage til dannelsen af brunt organisk kulstof under transporten af en røgfane. Kredit:Marcelo Guzman
- Tynd, strækbare biosensorer kan gøre operationen mere sikker
- Ingeniører producerer et fisheye -objektiv, der er helt fladt
- Hvilken teori forklarer dannelsen og bevægelsen af den ydre overflade jord?
- World Food Program vinder Nobels fredspris for sultbekæmpelse
- Hvad er nuklear pluse eller?
- Hvad ville være en bedre leder af varme .guld eller helium?


