Det er muligt at forklare ionet et givet atom, der sandsynligvis er form, hvis det er tilfældet?
Forståelse af det grundlæggende:
* atomer: De grundlæggende byggesten til stof. De består af en kerne (indeholdende protoner og neutroner) omgivet af elektroner.
* Elektroner: Negativt ladede partikler, der kredser om kernen i skaller eller energiniveau.
* Protoner: Positivt ladede partikler i kernen.
* neutroner: Neutrale partikler i kernen.
* ioner: Atomer, der har opnået eller mistet elektroner, hvilket resulterer i en nettopositiv eller negativ ladning.
Forudsigelse af iondannelse:
1. Valenselektroner: Nøglen er antallet af elektroner i den yderste skal af et atom, kendt som valenselektroner. Atomer har en tendens til at vinde eller miste elektroner for at opnå en stabil elektronkonfiguration, normalt med 8 elektroner i den yderste skal (oktetreglen).
2. octet regel: Atomer stræber efter at have en fuld ydre skal af elektroner til stabilitet.
3. Periodiske tendenser:
* Metaller: Metaller har en tendens til at * miste * elektroner til dannelse af positivt ladede ioner (kationer). Deres position på den periodiske tabel indikerer generelt, hvor mange elektroner de vil miste.
* ikke -metaller: Ikke -metaller har en tendens til at * vinde * elektroner til dannelse af negativt ladede ioner (anioner).
4. Elektropositivitet: Et atoms tendens til at miste elektroner. Metaller er mere elektropositive end ikke -metaller.
Eksempler:
* natrium (NA): Natrium har en valenselektron. Det vil * miste * dette elektron for at opnå en fuld ydre skal og danne en natriumion (Na +) med en +1 ladning.
* klor (Cl): Klor har syv valenselektroner. Det vil * vinde * en elektron for at opnå en fuld ydre skal og danne en chloridion (Cl-) med en -1 -ladning.
Undtagelser:
* Overgangsmetaller: Disse elementer kan danne flere ioner med forskellige ladninger på grund af kompleksiteten af deres elektronkonfigurationer.
* elementer med ufuldstændige ydre skaller: Nogle elementer som brint og helium følger ikke oktetreglen strengt.
Nøglefaktorer, der skal overvejes:
* Gruppenummer: Gruppenummeret på den periodiske tabel kan ofte indikere ladningen af en ion (undtagen for overgangsmetaller).
* Elektronkonfiguration: At forstå arrangementet af elektroner inden for et atom er afgørende for at forudsige iondannelse.
* Elektronegativitet: Et atoms evne til at tiltrække elektroner. Højere elektronegativitet favoriserer dannelse af anion.
Kortfattet: Du kan forudsige, at ion, som et atom sandsynligvis danner ved at overveje dets antal valenselektroner, dens position på den periodiske tabel og dens elektronegativitet.
 Varme artikler
Varme artikler
-
 Retsmedicinsk kemiker opdager brug af marihuana baseret på svedtestUAlbany retsmedicinsk kemiker Jan Halámek med kandidatstuderende forsker Mindy Hair. Kredit:Scott Freedman Retsmedicinsk kemiker Jan Halámek beviser, at vores egen sved ikke kun fortæller, hvor fu
Retsmedicinsk kemiker opdager brug af marihuana baseret på svedtestUAlbany retsmedicinsk kemiker Jan Halámek med kandidatstuderende forsker Mindy Hair. Kredit:Scott Freedman Retsmedicinsk kemiker Jan Halámek beviser, at vores egen sved ikke kun fortæller, hvor fu -
 Designet protein switch tillader hidtil uset kontrol over levende cellerLOCKR er en molekylær kontakt lavet af flere interagerende dele:en nøgle (sort) låser op for et bur (grå), afsløre et bioaktivt peptid (gult), som kan interagere med andre molekyler i cellen. LÅS, e
Designet protein switch tillader hidtil uset kontrol over levende cellerLOCKR er en molekylær kontakt lavet af flere interagerende dele:en nøgle (sort) låser op for et bur (grå), afsløre et bioaktivt peptid (gult), som kan interagere med andre molekyler i cellen. LÅS, e -
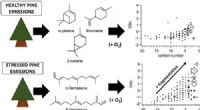 Bladlusstressede fyrretræer viser forskellig sekundær organisk aerosoldannelseKredit:American Chemical Society Planter udsender gasser, kaldet flygtige organiske forbindelser (VOCer), der kommer ind i atmosfæren, hvor de kan interagere med andre naturlige og menneskeskabte
Bladlusstressede fyrretræer viser forskellig sekundær organisk aerosoldannelseKredit:American Chemical Society Planter udsender gasser, kaldet flygtige organiske forbindelser (VOCer), der kommer ind i atmosfæren, hvor de kan interagere med andre naturlige og menneskeskabte -
 Forskere bruger tragtsyn til at være pionerer med billig og effektiv solenergiKredit:CC0 Public Domain Forskere har udviklet en banebrydende ny teknik, der kan låse op for nye metoder til at gøre solenergi mere effektiv. Et team af eksperter fra University of Exeter har op
Forskere bruger tragtsyn til at være pionerer med billig og effektiv solenergiKredit:CC0 Public Domain Forskere har udviklet en banebrydende ny teknik, der kan låse op for nye metoder til at gøre solenergi mere effektiv. Et team af eksperter fra University of Exeter har op
- Forskere præsenterer en plan for at bygge grønt
- Videnskabeligt team afdækker yderligere trussel mod Antarktis flydende ishylder
- Antarktis havis ramte endnu et lavpunkt i år - at forstå, hvordan havets opvarmning driver tabsnø…
- Er herpes simplex bakterie eller viral?
- Hvad er den semi-major-akse af jordens bane omkring solen?
- Hvilket er ikke en måde, hvorpå naturlig selektion påvirker fordelingen af fænotyper?


