Hvad tegner sig for komprimerbarheden af gasser sammenlignet med væsker og faste stoffer?
Her er en sammenbrud:
Gasser:
* bredt fordelt molekyler: Gasmolekyler er langt fra hinanden med store tomme mellemrum mellem dem.
* svage intermolekylære kræfter: De attraktive kræfter mellem gasmolekyler er meget svage.
* Høj kompressibilitet: Anvendelse af tryk på en gas tvinger molekylerne tættere sammen, hvilket reducerer det tomme rum. Dette er grunden til, at gasser er meget komprimerbare.
væsker:
* tættere molekyler: Flydende molekyler er tættere sammen end gasmolekyler, men har stadig noget mellemrum mellem dem.
* Moderat intermolekylære kræfter: Væsker har stærkere attraktive kræfter end gasser, men svagere end faste stoffer.
* Moderat kompressibilitet: Væsker er mindre komprimerbare end gasser, fordi deres molekyler er tættere, og de intermolekylære kræfter er stærkere. De er dog stadig lidt komprimerbare under højt tryk.
faste stoffer:
* tæt pakket molekyler: Faste molekyler pakkes tæt sammen med meget lidt plads mellem dem.
* Stærke intermolekylære kræfter: Faststoffer har de stærkeste intermolekylære kræfter i de tre stofstater.
* Lav kompressibilitet: Faste molekyler holdes stift på plads, hvilket gør det meget vanskeligt at skubbe dem tættere sammen. Dette er grunden til, at faste stoffer generelt betragtes som ukomprimerbare.
Kortfattet:
* Et stofs evne til at komprimeres er direkte relateret til rummet mellem dets molekyler og styrken af kræfterne, der holder dem sammen.
* Gasser har mest plads og de svageste kræfter, hvilket gør dem til de mest komprimerbare.
* Faststoffer har mindst plads og de stærkeste kræfter, hvilket gør dem til de mindst komprimerbare.
* Væsker falder et sted imellem.
Sidste artikelHvorfor udvides et solidt metal, når det opvarmes?
Næste artikelHvilken af disse er vanddamp, der blev skabt, når de koger?
 Varme artikler
Varme artikler
-
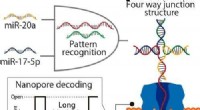 Nanopore-teknologi med DNA-beregning registrerer let mikroRNA-mønstre af lungekræftDNAer genkendte autonomt to mikroRNAer, miR-20a og miR-17-5p, og dannede en fire-vejs forbindelsesstruktur, der blev fanget i nanopore, viser lange blokeringsstrømme. Kredit:Figur tilpasset med tillad
Nanopore-teknologi med DNA-beregning registrerer let mikroRNA-mønstre af lungekræftDNAer genkendte autonomt to mikroRNAer, miR-20a og miR-17-5p, og dannede en fire-vejs forbindelsesstruktur, der blev fanget i nanopore, viser lange blokeringsstrømme. Kredit:Figur tilpasset med tillad -
 Kunstig intelligens hjælper forskere med at producere rekordsættende katalysator til kuldioxid-til…Forskere fra U of T Engineering og Carnegie Mellon University bruger elektrolysatorer som denne til at omdanne affalds-CO2 til kommercielt værdifulde kemikalier. Deres seneste katalysator, designet ti
Kunstig intelligens hjælper forskere med at producere rekordsættende katalysator til kuldioxid-til…Forskere fra U of T Engineering og Carnegie Mellon University bruger elektrolysatorer som denne til at omdanne affalds-CO2 til kommercielt værdifulde kemikalier. Deres seneste katalysator, designet ti -
 Naturinspirerede antibakterielle metallerKredit:pattyphotoart, Shutterstock Fra luftfart til medicin, forskellige sektorer bruger i stigende grad materialer, der efterligner lotusplanten, hvis blade har selvrensende egenskaber. Takket væ
Naturinspirerede antibakterielle metallerKredit:pattyphotoart, Shutterstock Fra luftfart til medicin, forskellige sektorer bruger i stigende grad materialer, der efterligner lotusplanten, hvis blade har selvrensende egenskaber. Takket væ -
 Høj opløsning, terahertz-drevet atomprobe tomografiIonfeltfordampning udløst af terahertz i en tomografisk atomprobe. (A) Ultrashort terahertz (røde) pulser er fokuseret på en metallisk nanotip inde i et højvakuumkammer. Den højspænding, der påføres d
Høj opløsning, terahertz-drevet atomprobe tomografiIonfeltfordampning udløst af terahertz i en tomografisk atomprobe. (A) Ultrashort terahertz (røde) pulser er fokuseret på en metallisk nanotip inde i et højvakuumkammer. Den højspænding, der påføres d
- Hvilke klipper bruges til at fremstille bygninger?
- Tror europæere, at sociale medier er skadelige?
- Hvilken tilstand af stof er phenolrød opløsning?
- ", 3, [[Kugleventil
- Kun 10% af Australiens oprindelige planter kan købes som frø:Sådan gør du plantning mere mangfol…
- Hvad er formålet med et magnetfelt?


