Har du ikke -metaller høje smeltepunkter?
Her er hvorfor:
* svage intermolekylære kræfter: Ikke -metaller danner svage intermolekylære kræfter som van der Waals -kræfter eller brintbindinger. Disse kræfter brydes let med relativt lave mængder energi, hvilket fører til lave smeltepunkter.
* kovalent binding: Ikke -metaller danner for det meste kovalente bindinger, hvor elektroner deles mellem atomer. Disse bindinger er stærke inden for et molekyle, men kræfterne mellem molekyler er svage.
* Undtagelser: Der er undtagelser som kulstof (i form af diamant) og bor, der har meget høje smeltepunkter på grund af deres unikke strukturer og stærke binding.
I modsætning hertil Metaller har høje smeltepunkter, fordi de har stærke metalliske bindinger. Disse bindinger involverer et hav af delokaliserede elektroner, der holder metalatomerne sammen stærkt.
 Varme artikler
Varme artikler
-
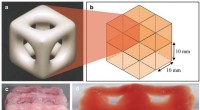 3-D-print skaber superbløde strukturer, der kopierer hjerne og lungerStruktur af en enkelt enhed; hvordan otte enheder passer sammen; to visninger af en trykt og fast struktur med otte enheder. Kredit:Imperial College London En ny 3D-printteknik gør det muligt for
3-D-print skaber superbløde strukturer, der kopierer hjerne og lungerStruktur af en enkelt enhed; hvordan otte enheder passer sammen; to visninger af en trykt og fast struktur med otte enheder. Kredit:Imperial College London En ny 3D-printteknik gør det muligt for -
 Bygninger:Det ubrydelige båndORNL-forskere producerede selvhelbredende og meget klæbende elastomerer, beviser, at de reparerer sig selv under omgivende forhold og under vandet. Kredit:ORNL/U.S. Institut for Energi Forskere ve
Bygninger:Det ubrydelige båndORNL-forskere producerede selvhelbredende og meget klæbende elastomerer, beviser, at de reparerer sig selv under omgivende forhold og under vandet. Kredit:ORNL/U.S. Institut for Energi Forskere ve -
 Video:Den eneste detox, du nogensinde får brug forKredit:The American Chemical Society Folk taler hele tiden om, hvordan de skal afgifte. Og der er en række virksomheder, der er en kilometer lang og venter på at sælge juicer og smoothies til dig
Video:Den eneste detox, du nogensinde får brug forKredit:The American Chemical Society Folk taler hele tiden om, hvordan de skal afgifte. Og der er en række virksomheder, der er en kilometer lang og venter på at sælge juicer og smoothies til dig -
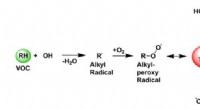 Identifikation af et undvigende molekyle nøgle til forbrændingskemiEt diagram, der viser, hvordan oxidationen af flygtige organiske forbindelser (VOC) kan forbruge og regenerere OH-radikaler. Et alkylradikal (R•) reagerer med oxygen og danner et alkylperoxyradikal
Identifikation af et undvigende molekyle nøgle til forbrændingskemiEt diagram, der viser, hvordan oxidationen af flygtige organiske forbindelser (VOC) kan forbruge og regenerere OH-radikaler. Et alkylradikal (R•) reagerer med oxygen og danner et alkylperoxyradikal


