Hvordan adskiller faste væskergasser sig fra hinanden på molekylært niveau?
faste stoffer:
* Stærke intermolekylære kræfter: Molekyler i faste stoffer er tæt pakket sammen og holdes på plads af stærke intermolekylære kræfter som ioniske bindinger, kovalente bindinger og metalliske bindinger.
* fast position og lav bevægelsesfrihed: Molekyler i faste stoffer vibrerer rundt om faste positioner med meget lidt translationel eller rotationsfrihed.
* bestemt form og volumen: Faststoffer opretholder deres form og volumen på grund af de stærke kræfter, der holder molekylerne på plads.
væsker:
* Moderat intermolekylære kræfter: Molekyler i væsker er tættere sammen end i gasser, men med svagere intermolekylære kræfter end i faste stoffer. De kan være hydrogenbindinger, dipol-dipol-interaktioner eller London-spredningskræfter.
* Begrænset bevægelse og variabel position: Væsker har mere bevægelsesfrihed end faste stoffer, hvilket gør det muligt for molekyler at glide forbi hinanden. De tager formen på deres beholder, men har et fast volumen.
* ubestemt form og bestemt volumen: Væsker har formen på deres beholder, men deres volumen forbliver konstant.
Gasser:
* svage intermolekylære kræfter: Gasmolekyler er langt fra hinanden og har meget svage intermolekylære kræfter. De er primært påvirket af van der Waals -styrker.
* Høj bevægelsesfrihed: Gasmolekyler bevæger sig tilfældigt og uafhængigt med høj translationel og rotationsfrihed.
* ubestemt form og volumen: Gasser udvides til at fylde deres beholder og tager både form og volumen af beholderen.
Her er en tabel, der opsummerer de vigtigste forskelle:
| Ejendom | Faste stoffer | Væsker | Gasser |
| ------------------- | ---------------- | ----------------- | ----------------- |
| Intermolekylære kræfter | Stærk | Moderat | Svag |
| molekylær bevægelse | Vibrerer i faste positioner | Skub forbi hinanden | Fri bevægelighed |
| form | Bestemt | Ubestemt | Ubestemt |
| volumen | Bestemt | Bestemt | Ubestemt |
Husk, at dette er idealiserede beskrivelser, og der er undtagelser og nuancer. For eksempel udviser nogle faste stoffer en vis grad af fluiditet, mens nogle gasser kan komprimeres i en flydende tilstand.
Sidste artikelHar du ikke -metaller høje smeltepunkter?
Næste artikelNår faste ændringer i væske?
 Varme artikler
Varme artikler
-
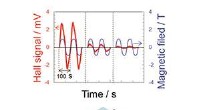 Daggry af organisk enkeltkrystal elektronikForskere ved Institute for Molecular Science, National Institutes of Natural Sciences (Japan) har udviklet en metode til højtydende doping af organisk enkeltkrystal. Desuden, det lykkedes dem at måle
Daggry af organisk enkeltkrystal elektronikForskere ved Institute for Molecular Science, National Institutes of Natural Sciences (Japan) har udviklet en metode til højtydende doping af organisk enkeltkrystal. Desuden, det lykkedes dem at måle -
 Ultratynde lag af rust genererer elektricitet fra strømmende vandKredit:Morteza Akhnia/Unsplash Der er mange måder at generere elektricitet på – batterier, solpaneler, vindturbine, og vandkraftdæmninger, for at nævne et par eksempler... og nu, der er rust. Ny
Ultratynde lag af rust genererer elektricitet fra strømmende vandKredit:Morteza Akhnia/Unsplash Der er mange måder at generere elektricitet på – batterier, solpaneler, vindturbine, og vandkraftdæmninger, for at nævne et par eksempler... og nu, der er rust. Ny -
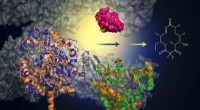 Forskere udvikler grønnere og mere effektiv metode til fremstilling af næste generations antibioti…Med tilføjelsen af en murin-afledt biokatalysator (grøn), kan dette konstruerede protein tilføje et fluoridatom for at skabe makrolidanaloger (struktur, til højre). Denne tilgang tilbyder en grønner
Forskere udvikler grønnere og mere effektiv metode til fremstilling af næste generations antibioti…Med tilføjelsen af en murin-afledt biokatalysator (grøn), kan dette konstruerede protein tilføje et fluoridatom for at skabe makrolidanaloger (struktur, til højre). Denne tilgang tilbyder en grønner -
 Gennembrud i sur vandelektrolyse via rutheniumbaserede katalysatorerIltudviklingsreaktion (OER) og oxygenreduktionsreaktion (ORR) kan betragtes som to trofæer inden for effektiv udnyttelse af brintenergi. Imidlertid, i sur OER, et stort anvendt potentiale var påkrævet
Gennembrud i sur vandelektrolyse via rutheniumbaserede katalysatorerIltudviklingsreaktion (OER) og oxygenreduktionsreaktion (ORR) kan betragtes som to trofæer inden for effektiv udnyttelse af brintenergi. Imidlertid, i sur OER, et stort anvendt potentiale var påkrævet
- Forskere finder måde at fremstille mineraler, som kan fjerne CO2 fra atmosfæren
- E-tekstiler styrer husholdningsapparater med en fingerstreg
- Undersøgelse viser, hvordan rester af avocadobeskæring kan bruges til at producere mere bæredygti…
- Kæmpe variation fundet i forhåbninger hos elever, der forlader skolen, alt efter hvor de studerer
- Eksotiske dyr og jagten på guld
- Nissen kan afsløre Planet X's fantom, der lurer i dybt rum


