Hvordan opløses vand polariteten af hjælp opløses faste stoffer?
1. Vandets polære natur:
* Vandmolekyler har en bøjet form, hvor ilt er lidt negative og brintatomer er lidt positive. Denne ujævne fordeling af ladning skaber en dipol , hvilket gør vand til et polært molekyle .
2. Attraktive kræfter:
* ioniske forbindelser: Når ioniske forbindelser som salt (NaCl) tilsættes til vand, tiltrækkes de positivt ladede natriumioner (Na+) af den negativt ladede ilt ende af vandmolekyler. Tilsvarende tiltrækkes de negativt ladede chloridioner (Cl-) af de positivt ladede brintender af vandmolekyler. Disse attraktioner overvinder de ioniske bindinger, der holder saltet sammen, hvilket får det til at opløses.
* polære kovalente forbindelser: Polære kovalente forbindelser som sukker (saccharose) opløses også i vand på grund af lignende attraktive kræfter. De polære ender af vandmolekylerne interagerer med de polære dele af sukkermolekylet, forstyrrer sukkerets indre bindinger og lader det opløses.
3. Hydrering:
* Processen med vandmolekyler omgivende og isolerende ioner eller polære molekyler kaldes hydrering . Den stærke tiltrækning mellem vandmolekyler og de opløste partikler svækker kræfterne, der holder opløsningen sammen, hvilket får den til at opløses.
4. "Som opløser som":
* Dette princip siger, at polære stoffer opløses i polære opløsningsmidler, og ikke -polære stoffer opløses i ikke -polære opløsningsmidler. Vand, der er et polært opløsningsmiddel, opløses effektivt polære og ioniske stoffer.
Sammenfattende tillader vandets polaritet at:
* Form stærke attraktioner med ladede eller polære molekyler.
* Overvinde kræfterne, der holder opløsningen sammen.
* Omgivet og isolere opløste partikler gennem hydrering, hvilket fører til opløsning.
Vigtig note: Mens vand er et godt opløsningsmiddel for mange stoffer, kan det ikke opløse alle faste stoffer. Ikke -polære stoffer som olie og fedt er ikke opløselige i vand, fordi vandets polaritet ikke kan overvinde deres svage intermolekylære kræfter.
 Varme artikler
Varme artikler
-
 Fremstilling af polymerstrukturer hurtigere - to processer i en maskineMålet er at bruge kombimaskinen til at producere forgrenede mikrorør samt komplette mikrofluidiske systemer. Kredit:Fraunhofer ILT, Aachen, Tyskland Enten hurtigt eller præcist - begge dele kan ik
Fremstilling af polymerstrukturer hurtigere - to processer i en maskineMålet er at bruge kombimaskinen til at producere forgrenede mikrorør samt komplette mikrofluidiske systemer. Kredit:Fraunhofer ILT, Aachen, Tyskland Enten hurtigt eller præcist - begge dele kan ik -
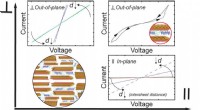 Selvmontering, biomimetiske kompositter besidder usædvanlige elektriske egenskaberBiomimetiske kompositter fremstilles ved topologiske interaktioner, udvidelse af grænserne for de fysiske egenskaber, såsom elektrisk ledningsevne. Kredit:Mert Vural, Penn State Sommetider, bryde
Selvmontering, biomimetiske kompositter besidder usædvanlige elektriske egenskaberBiomimetiske kompositter fremstilles ved topologiske interaktioner, udvidelse af grænserne for de fysiske egenskaber, såsom elektrisk ledningsevne. Kredit:Mert Vural, Penn State Sommetider, bryde -
 Forskere klokke DNAs restitutionstid efter kemoterapiDNA, som har en dobbelt helix struktur, kan have mange genetiske mutationer og variationer. Kredit:NIH I den tid det tager for en Amazon Prime-levering at ankomme, celler beskadiget af kemoterapi
Forskere klokke DNAs restitutionstid efter kemoterapiDNA, som har en dobbelt helix struktur, kan have mange genetiske mutationer og variationer. Kredit:NIH I den tid det tager for en Amazon Prime-levering at ankomme, celler beskadiget af kemoterapi -
 Hvad gør kobolt afgørende for livet?Kredit:Wikipedia Cobalt sidder i midten af corrinringen af vitamin B12 og de vigtige cobalaminer, vi får fra det. Måske overraskende er det kun to af vores enzymer, der gider bruge disse smerte
Hvad gør kobolt afgørende for livet?Kredit:Wikipedia Cobalt sidder i midten af corrinringen af vitamin B12 og de vigtige cobalaminer, vi får fra det. Måske overraskende er det kun to af vores enzymer, der gider bruge disse smerte
- Hvad der går ned i afløbet, fra ibuprofen til sæber, bliver slået ud via giftigt slam, advarer f…
- Kan jeg blande disse kemikalier? Der er en app til det!
- Bidrag fra cellestudie af Robert Hooke?
- Forenkling af hudsygdomsdiagnose med aktuel nanoteknologi
- Hvad er de fleste af elementerne lavet af?
- Hvad er produktet af propyn, der reagerer med hydrogenchlorid?


