Hvad gør kobolt afgørende for livet?

Kredit:Wikipedia
Cobalt sidder i midten af corrinringen af vitamin B12 og de vigtige cobalaminer, vi får fra det. Måske overraskende er det kun to af vores enzymer, der gider bruge disse smerteligt konstruerede og omhyggeligt kanaliserede cofaktorer. Hvorfor gør vores celler så meget for at få en lille smule af koboltmagien, og hvilke katalytiske egenskaber kan gøre det så specielt?
Andre ualmindelige essentielle metaller, som molybdæn, selen og jod, bruges på samme måde kun sparsomt i celler, og alligevel bevarer vi evnen til fuldstændigt at syntetisere alle de nyttige derivater for disse grundstoffer. For at tæmme molybdæn konstruerer vi en omfattende molybdopterin-cofaktor, mens vi for at udnytte jod samler thyroxin. For at inkorporere selen i de få selenoproteiner, der kræver det, blander det omfattende SECIS-maskineri mRNA-koden for at tiltrække et unikt tRNA, hvorpå dets cysteinlast omdannes til selenocystein. I hvert af disse tilfælde forstår forskerne de særlige egenskaber ved de involverede metaller, der gør dem uundværlige.
For eksempel, sammenlignet med svovl, er selen en bedre nukleofil, der vil reagere hurtigere med reaktive oxygenarter, men dens mangel på π-bindingskarakter betyder, at den også lettere kan reduceres. Selenoproteiner som GPX4 (glutathionperoxidase) er tilsvarende mere modstandsdygtige over for både overoxidation og irreversibel inaktivering. Tilsvarende afspejler det uundgåelige krav til molybdæn, en to-elektron redoxforbindelse, der kan pendle mellem +4/+5 og +5/+6 redoxparrene, adskillige ikke så almindelige færdigheder. Den kan udføre forskellige og energisk udfordrende redoxreaktioner; det kan fungere som en elektronsænk eller kilde ved lavt redoxpotentiale; og (sammen med det meget sjældnere wolfram) effektivt kan overføre oxygen- og svovlatomer under reaktioner, der finder sted ved lavt potentiale.
Et bemærkelsesværdigt forsøg på at spå om den væsentlige koboltkarakter blev fremført i en nylig kommentar i PNAS af den ekstraordinære geokemiker Michael Russell. Ligger mellem Fe og Ni i det periodiske system, bemærker Russell, at "grundstoffet er særligt 'energitæt' med parrede elektroner i den ydre bane. Dets forekomst som en metallegering i serpentinitter med en variabel valens, der strækker sig fra Co + frem til Co4 + , dens forskellige spin-tilstande og dens kontrasterende konformationer gør den unik, med utallige bidrag, der skal ydes til elektronik, katalyse og livets fremkomst. Faktisk er Co-Fe-samarbejde netop blevet undersøgt i den modsatte ende af redoxspektret - elektrokatalysen af O2 evolution reaktion. Substitutioner af Co er enten umulige, som i metabolisme og i en eller anden dobbelt-atom katalyse, eller også ligger de i en noget fjern fremtid."
Russells kommentarer er som svar på en tidligere artikel af He et. al. som påviste, at hydrotermisk reduktion af bicarbonat til langkædede carbonhydrider (≤24 carbonatomer) er mulig ved brug af jern- og koboltmetaller. Disse fund forklarer potentielt både den abiogene oprindelse af olie og nøglebegivenheder i livets fremkomst. Da rester af porphyriner og corriner, der er kritiske for liv, kan findes midt i olieforekomster, bliver et kritisk spørgsmål:Opfandt livet disse molekyler, eller brugte de først abiotiske faksimiler af disse molekyler og udviklede først senere den samtidige evne til at syntetisere dem for sig selv?
Svaret på mit spørgsmål fra Russell var, at livet efter hans mening sandsynligvis opfandt corrin-lignende koordination ved hjælp af et fire-aminosyre-peptid glycin-glycin-histidin-motiv, der var i stand til at fange cobaltatomet. Mærkeligt nok skal porphyriner, som huser jern eller kobber i deres centre, og chloriner, som gør det samme med magnesium, trækkes sammen til corriner for at binde kobolt. Denne specificitet kommer tilsyneladende på trods af de næsten identiske atomradier (omkring 125 pm) for den sammenhængende Fe, Co, Ni, Cu elementære lineup. Efter Russells opfattelse var kobolt (og andre overgangsmetaller), der krævedes ved livets fremkomst, aktive i aflejringer af mineralet grøn rust, også kendt som fougerit, ved alkaliske hydrotermiske ventilationskanaler. Cobalt corrinoid sammen med jern-svovl-klynger danner hjertet af primitive acetylcoenzym-A-baner af acetogenerne og methanogenerne, der ligger i bunden af vores evolutionære træ. Dette Co(FeS)-protein medierer binding eller løsrivelse af en methylgruppe til eller fra carbonmonoxid eller en anden enhed involveret i biosyntesen af acetyl-CoA.
Den form for vitamin B12, der bruges af vores methylmalonyl-CoA-mutaseenzym, der er placeret i mitokondrier, til nedbrydning af fedtsyrer og aminosyrer, er kendt som adenosylcobalamin (AdoCbl). Det andet cobalamin-udnyttende enzym, methioninsyntase, virker i cytosolen og anvender en methylcobalamin-cofaktor, hvor adenosylgruppen er erstattet af en methylgruppe. Landplanter og svampe hverken syntetiserer eller kræver cobalamin, da de mangler methylmalonyl-CoA-mutase og har forskellige slags methioninsyntase, der ikke kræver B12. Når disse enzymer ikke fungerer korrekt, kan deres prækursormolekyler formodentlig bygge op til høje niveauer, hvilket forårsager problemer som demyeliniserende sygdom og perniciøs anæmi.
Mens kobolts termiske stabilitet og høje energitæthed gør det til en ideel komponent til katoderne i lithiumbatterier, kommer dets brugbarhed til livet fra dets mange andre unikke egenskaber, nogle opdaget, og nogle er endnu ikke fundet.
Sidste artikelSådan optimerer du processen med polymerekstrudering
Næste artikelVideo:Hvad er oktan egentlig?
 Varme artikler
Varme artikler
-
 Søger en behandling for IBS-smerter i tarantelgiftEt molekyle afledt af giften fra en peruviansk tarantel kunne være en kilde til kronisk IBS smertelindring. Kredit:Geno EJ Sajko Photography/Shutterstock.com Til patienter med inflammatorisk tarms
Søger en behandling for IBS-smerter i tarantelgiftEt molekyle afledt af giften fra en peruviansk tarantel kunne være en kilde til kronisk IBS smertelindring. Kredit:Geno EJ Sajko Photography/Shutterstock.com Til patienter med inflammatorisk tarms -
 Fanger af rugmetoden opdager rugglutenproteiner i fødevarerKredit:American Chemical Society Glutenfri diæter har været trendy i flere år nu, med tilhængere, der hævder, at undgå korn, der indeholder stoffet, hjælper med vægttab eller forbedrer det generel
Fanger af rugmetoden opdager rugglutenproteiner i fødevarerKredit:American Chemical Society Glutenfri diæter har været trendy i flere år nu, med tilhængere, der hævder, at undgå korn, der indeholder stoffet, hjælper med vægttab eller forbedrer det generel -
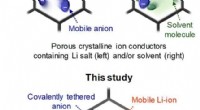 Undersøgelse:Ny opløsningsmiddelfri, enkelt lithium-ion-ledende kovalent organisk skeletVist ovenfor er de konceptuelle illustrationer af iontransportfænomener i de porøse krystallinske ionledere:tidligere tilgange (øverst) og denne undersøgelse (nederst). Kredit:UNIST En nylig under
Undersøgelse:Ny opløsningsmiddelfri, enkelt lithium-ion-ledende kovalent organisk skeletVist ovenfor er de konceptuelle illustrationer af iontransportfænomener i de porøse krystallinske ionledere:tidligere tilgange (øverst) og denne undersøgelse (nederst). Kredit:UNIST En nylig under -
 Hvordan motion kan hjælpe med at bekæmpe stofmisbrugKredit:American Chemical Society Sirenekaldet fra vanedannende stoffer kan være svært at modstå, og at vende tilbage til det miljø, hvor der tidligere blev taget stoffer, kan gøre modstanden så me
Hvordan motion kan hjælpe med at bekæmpe stofmisbrugKredit:American Chemical Society Sirenekaldet fra vanedannende stoffer kan være svært at modstå, og at vende tilbage til det miljø, hvor der tidligere blev taget stoffer, kan gøre modstanden så me
- Det første additivt fremstillede termiske beskyttelsesskjold skal ud i rummet
- Langsigtet trussel mod Mauritius-økologi efter udslip:Japanske eksperter
- En magnetar vågnede lige efter tre års tavshed
- Millioner tåler rekordkulde uden strøm; mindst 20 døde
- Ny applikation kan registrere Twitter-bots på ethvert sprog
- Undersøgelse finder betydelige omkostninger for arbejdere med alvorlige COVID-19-sygdomme


