Navn på fire måder, hvorpå den kemiske karakter af vandmolekyle letter livet?
1. universelt opløsningsmiddel: Vands polaritet, med sin lidt positive brintende og lidt negative ilt ende, giver den mulighed for at opløse en lang række stoffer. Dette er afgørende for at transportere næringsstoffer, fjerne affaldsprodukter og lette kemiske reaktioner inden for celler og organismer.
2. Høj varmekapacitet: Vands stærke brintbindinger kræver en betydelig mængde energi for at bryde, hvilket giver det en høj varmeevne. Dette hjælper organismer med at opretholde en stabil indre temperatur og modstå ekstreme temperatursvingninger.
3. sammenhængende og klæbende egenskaber: Vandmolekyler tiltrækkes stærkt af hinanden (samhørighed) og til andre polære molekyler (adhæsion). Disse egenskaber er afgørende for plantetranspiration, overfladespænding og bevægelse af væsker inden for organismer.
4. Densitetsanomali: Vand er mest tæt ved 4 ° C. Denne unikke egenskab gør det muligt for vandmasser at fryse ovenfra og ned, hvilket giver isolering til akvatisk liv om vinteren.
Sidste artikelIndeholder alle organiske molekyler kulstof?
Næste artikelSkriv nedbrydningen af H2CO3 og KCLO3?
 Varme artikler
Varme artikler
-
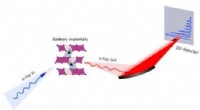 Overbygningens rolle i førstegangsspændingstab i lithium-ion-batterierFigur 1. Den typiske konfiguration af et RIXS-eksperiment. Indkommende røntgenstråler med høj energiopløsning skinner på prøverne, og de spredte røntgenstråler opløses i energi og bliver opsamlet af e
Overbygningens rolle i førstegangsspændingstab i lithium-ion-batterierFigur 1. Den typiske konfiguration af et RIXS-eksperiment. Indkommende røntgenstråler med høj energiopløsning skinner på prøverne, og de spredte røntgenstråler opløses i energi og bliver opsamlet af e -
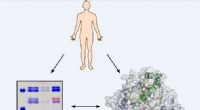 Ny cellulær billeddannelse baner vej for kræftbehandlingEt menneske, et enzym og nogle gelbånd - fluorescerende billeddannende midler visualiserer enzymaktivitet i sundt og sygt væv. Dette vil hjælpe med design og vurdering af mere effektive lægemidler mod
Ny cellulær billeddannelse baner vej for kræftbehandlingEt menneske, et enzym og nogle gelbånd - fluorescerende billeddannende midler visualiserer enzymaktivitet i sundt og sygt væv. Dette vil hjælpe med design og vurdering af mere effektive lægemidler mod -
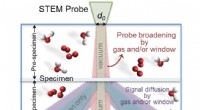 Bestemmelse af parametrene for transmissionselektronmikroskopiGaseffekter på spredning af hurtige elektroner, der bidrager til ESTEM -sonden og signalet. Kredit:Pacific Northwest National Laboratory Selvom telefonerne i vores lommer måske er perfekte til at
Bestemmelse af parametrene for transmissionselektronmikroskopiGaseffekter på spredning af hurtige elektroner, der bidrager til ESTEM -sonden og signalet. Kredit:Pacific Northwest National Laboratory Selvom telefonerne i vores lommer måske er perfekte til at -
 Analytiske metoder hjælper med at udvikle modgift mod cyanid, sennepsgasProfessor Brian Logue, venstre, ser som postdoktoral forskningsassistent Erica Manandhar pipetterer blod i centrifugerør. Kredit:South Dakota State University For at udvikle modgift mod kemiske mi
Analytiske metoder hjælper med at udvikle modgift mod cyanid, sennepsgasProfessor Brian Logue, venstre, ser som postdoktoral forskningsassistent Erica Manandhar pipetterer blod i centrifugerør. Kredit:South Dakota State University For at udvikle modgift mod kemiske mi


