Hvordan er metallisk binding blevet brugt til at redegøre for mange fysiske egenskaber ved metaller, såsom elektrisk ledningsevne og formbarhed?
Elektrisk ledningsevne:
* Hav af elektroner: Metallisk binding involverer et "hav" af delokaliserede elektroner, hvilket betyder, at disse elektroner ikke er bundet til noget specifikt atom og kan bevæge sig frit gennem metalens struktur.
* Elektronmobilitet: Når et elektrisk potentiale påføres på tværs af et metal, kan disse frie elektroner let bevæge sig som svar på det elektriske felt, bære ladningen og skabe en elektrisk strøm. Denne frie bevægelse af elektroner er det, der gør metaller fremragende ledere af elektricitet.
formbarhed:
* Ikke-retningsbestemt binding: Metalliske bindinger er ikke-retningsbestemte, hvilket betyder, at de ikke er begrænset til specifikke vinkler eller retninger mellem atomer.
* Lagstruktur: Dette gør det muligt for metalatomer let at glide forbi hinanden uden at bryde bindingerne, hvilket giver metaller muligheden for at blive hamret, bøjet eller strækket i forskellige former uden at sprænge.
* Elektronfleksibilitet: De delokaliserede elektroner kan justere deres positioner, når atomer bevæger sig, hvilket yderligere bidrager til fleksibiliteten i den metalliske struktur.
Kortfattet:
* Tilstedeværelsen af et hav af delokaliserede elektroner i metallisk binding muliggør den høje elektriske ledningsevne observeret i metaller.
* Den ikke-retningsbestemte karakter af metalliske bindinger og mobiliteten af elektroner giver metalatomer mulighed for at bevæge sig i forhold til hinanden, hvilket fører til deres formbarhed.
Det er vigtigt at bemærke, at den specifikke styrke af disse egenskaber kan variere afhængigt af metaltypen og dens krystalstruktur. For eksempel er nogle metaller mere formbare end andre, og nogle er bedre elektriske ledere. Imidlertid forklarer de grundlæggende principper for metallisk binding, hvorfor disse egenskaber generelt er karakteristiske for metaller.
Sidste artikelHvad resulterer hydrolysen af et neutralt fedt i?
Næste artikelEr bordsalt et stof eller en blanding?
 Varme artikler
Varme artikler
-
 Forskere styrker det svageste led i fremstilling af stærke materialerOverfladeudseende af det udviklede stål indeholdende kobber (venstre) og kobberfrit modstykke (højre). Kredit:Kenta Yamanaka et al, Tohoku Universitet Industriel og bilmaskiner, såsom bildele i mo
Forskere styrker det svageste led i fremstilling af stærke materialerOverfladeudseende af det udviklede stål indeholdende kobber (venstre) og kobberfrit modstykke (højre). Kredit:Kenta Yamanaka et al, Tohoku Universitet Industriel og bilmaskiner, såsom bildele i mo -
 Teknologier til enkeltcellet RNA-profilering kan hjælpe med at dissekere de cellulære baser af kom…Alex K. Shalek, en MIT-lektor i kemi, bruger teknologier såsom enkeltcellet RNA-sekventering til at analysere forskelle i genekspressionsmønstre for individuelle celler og til at finde ud af, hvordan
Teknologier til enkeltcellet RNA-profilering kan hjælpe med at dissekere de cellulære baser af kom…Alex K. Shalek, en MIT-lektor i kemi, bruger teknologier såsom enkeltcellet RNA-sekventering til at analysere forskelle i genekspressionsmønstre for individuelle celler og til at finde ud af, hvordan -
 Tricky feat med stand-up molekyleOprejst PTCDA -molekyle på en sølvplatform (til venstre); normalt aflejres molekylet fladt mod det flade lag af sølvatomer (til højre). Kredit:Forschungszentrum Jülich / T. Esat I de seneste årtie
Tricky feat med stand-up molekyleOprejst PTCDA -molekyle på en sølvplatform (til venstre); normalt aflejres molekylet fladt mod det flade lag af sølvatomer (til højre). Kredit:Forschungszentrum Jülich / T. Esat I de seneste årtie -
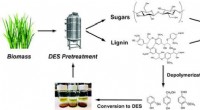 Vedvarende opløsningsmidler afledt af lignin sænker spild i biobrændstofproduktionBioraffinaderi-konceptet, der bruger fornybare dybe eutektiske opløsningsmidler (DES) afledt af ligninråvarer, er vist her. Kredit:US Department of Energy Et bioraffinaderi med lukket kredsløb kan
Vedvarende opløsningsmidler afledt af lignin sænker spild i biobrændstofproduktionBioraffinaderi-konceptet, der bruger fornybare dybe eutektiske opløsningsmidler (DES) afledt af ligninråvarer, er vist her. Kredit:US Department of Energy Et bioraffinaderi med lukket kredsløb kan
- Hvilke typer sten kan vejr og slid væk for at danne sediment?
- Hvor er månen på sin bane, når du ikke kan se den?
- Østrigs Max Schrems:Amerikanske højteknologiske giganters værste mareridt?
- David og Goliath:Hvornår drager underdog-virksomheder fordel af naboskabsgiganter?
- Undersøgelse finder, at virtual reality -træning kan forbedre medarbejdernes sikkerhed
- Hvor meget kobber er der i 10 pund titanium?


