Hvad kan udlede om tiltrækningen mellem partikler i et stof med lavt smeltepunkt?
* smeltepunkt: Dette er den temperatur, hvorpå en solid overgår til en væske. Det er i det væsentlige et mål for, hvor meget energi der er nødvendig for at overvinde de attraktive kræfter, der holder partiklerne sammen i en fast, solid struktur.
* svage attraktioner: Hvis der kun er behov for en lille mængde energi for at bryde disse attraktioner og lade partikler bevæge sig mere frit (som i en væske), skal attraktionerne mellem dem være svage.
Eksempler:
* vand (H₂O): Har et relativt lavt smeltepunkt (0 ° C) på grund af hydrogenbindingen mellem molekyler. Mens hydrogenbindinger er stærkere end typiske dipol-dipol-kræfter, er de stadig relativt svage sammenlignet med ioniske eller kovalente bindinger.
* helium (He): Har et ekstremt lavt smeltepunkt (-272,2 ° C), den laveste af alle elementer. Dette skyldes, at heliumatomer kun holdes sammen af svage London -spredningskræfter, som er midlertidige og meget let overvinde.
I modsætning:
* stoffer med høje smeltepunkter , såsom metaller og ioniske forbindelser, har stærke attraktive kræfter mellem deres partikler. Dette kræver en masse energi for at bryde fra hinanden og smelte dem.
Kortfattet: Et lavt smeltepunkt indikerer, at partiklerne i et stof holdes sammen af svage tiltrækningskræfter.
 Varme artikler
Varme artikler
-
 Nye molekyler til innovative højteknologiske materialerSkematisk fremstilling af en sandwichforbindelse med en bundring sammensat af forskellige elementer. Kredit:KIT Takket være deres særlige egenskaber, sjældne jordarter bruges i mange højteknologis
Nye molekyler til innovative højteknologiske materialerSkematisk fremstilling af en sandwichforbindelse med en bundring sammensat af forskellige elementer. Kredit:KIT Takket være deres særlige egenskaber, sjældne jordarter bruges i mange højteknologis -
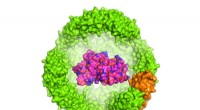 Forskere folder et protein i et proteinIllustration af et protein af interesse (POI) inde i en 24-underenhed Archeoglobus fulgidus ferritin exoshell, som er 12 nanometer i diameter (kun halvdelen af skallen er vist). Kredit:Dr. Chester L
Forskere folder et protein i et proteinIllustration af et protein af interesse (POI) inde i en 24-underenhed Archeoglobus fulgidus ferritin exoshell, som er 12 nanometer i diameter (kun halvdelen af skallen er vist). Kredit:Dr. Chester L -
 Vanilje får mælkedrikke til at virke sødereKredit:CC0 Public Domain Tilsætning af vanilje til sødet mælk får forbrugerne til at tro, at drikkevaren er sødere, gør det muligt at reducere mængden af tilsat sukker, ifølge forskere fra Penn
Vanilje får mælkedrikke til at virke sødereKredit:CC0 Public Domain Tilsætning af vanilje til sødet mælk får forbrugerne til at tro, at drikkevaren er sødere, gør det muligt at reducere mængden af tilsat sukker, ifølge forskere fra Penn -
 IcePic-algoritmen klarer sig bedre end mennesker i at forudsige iskrystaldannelseEn repræsentation af de mange forskellige materialer, der undersøges for deres potentiale til at kontrollere isdannelse. Kredit:Michael B. Davies Cambridge-forskere har udviklet en kunstigt intelli
IcePic-algoritmen klarer sig bedre end mennesker i at forudsige iskrystaldannelseEn repræsentation af de mange forskellige materialer, der undersøges for deres potentiale til at kontrollere isdannelse. Kredit:Michael B. Davies Cambridge-forskere har udviklet en kunstigt intelli
- Kan det virkelig betale sig at være vært for OL, VM eller andre store sportsbegivenheder?
- Ingeniører manipulerer en buckyball ved at indsætte et enkelt vandmolekyle
- Kan en planetarisk geolog være astronaut?
- Hvilke hppens til energien fra fotoner, når du bevæger dig synligt lys mod x -stråler og gammastr…
- Hvilket instrument kunne bruges til at få fjerne objekter til at virke større og nærmere?
- Forskere tager det første kig ind i øjnene på majoranas


