Forklar, hvordan de attraktive kræfter mellem partikler i en væske- og ligevægtsdamptryk af det relaterede?
1. Intermolekylære kræfter og fordampning:
* stærkere attraktive kræfter: Når de attraktive kræfter mellem flydende molekyler er stærke (som i vand med hydrogenbinding), tager det mere energi at overvinde disse kræfter og flygte ind i dampfasen. Dette betyder, at færre molekyler vil have nok energi til at fordampe ved en given temperatur, hvilket resulterer i et lavere damptryk.
* svagere attraktive kræfter: Omvendt har væsker med svagere attraktive kræfter (som diethylether med kun van der Waals -styrker) lavere kogepunkter. Dette skyldes, at der kræves mindre energi for at bryde de intermolekylære bindinger og komme ind i dampfasen. Derfor har de et højere damptryk.
2. Ligevægtsdamptryk:
* dynamisk ligevægt: Ligevægtsdamptrykket er det tryk, der udøves af dampen, når det er i dynamisk ligevægt med væsken. Dette betyder, at fordampningshastigheden er lig med kondensationshastigheden.
* Effekt af attraktive kræfter: Væsker med stærkere intermolekylære kræfter har et lavere damptryk, fordi færre molekyler kan undslippe i dampfasen ved en given temperatur. Dette skaber et lavere tryk i dampfasen ved ligevægt.
3. Clausius-clapeyron ligning:
Clausius-clapeyron-ligningen beskriver matematisk forholdet mellem damptryk og temperatur, og det inkorporerer fordampningens entalpi (som er relateret til styrken af intermolekylære kræfter):
`` `
Ln (P2/P1) =-ΔHVAP/R * (1/T2 - 1/T1)
`` `
Hvor:
* P1 og P2 er damptryk ved temperaturer T1 og T2
* ΔHVAP er entalpien af fordampning
* R er den ideelle gaskonstant
Kortfattet:
De attraktive kræfter mellem partikler i en væske påvirker direkte dens ligevægtsdamptryk. Stærkere attraktive kræfter fører til lavere damptryk, fordi det kræver mere energi for molekyler for at flygte ind i dampfasen. Dette forhold er grundlæggende for at forstå væskernes opførsel og deres evne til at fordampe.
Sidste artikelHvad gør noget til en stærk syre?
Næste artikelHvilken erklæring beskriver bedst ionisk binding?
 Varme artikler
Varme artikler
-
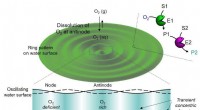 Spatiotemporal regulering af kemiske reaktioner ved kun at bruge hørbar lydFigur 1. Hørbar lydinduceret generering af transiente domæner og spatiotemporalt kontrollerede kaskadereaktionsnetværk. Kredit:Institut for Grundvidenskab Spatiotemporal regulering af flertrins enz
Spatiotemporal regulering af kemiske reaktioner ved kun at bruge hørbar lydFigur 1. Hørbar lydinduceret generering af transiente domæner og spatiotemporalt kontrollerede kaskadereaktionsnetværk. Kredit:Institut for Grundvidenskab Spatiotemporal regulering af flertrins enz -
 Forskerhold dechifrerer enzymatisk nedbrydning af sukker fra marine algerEnzymer er biokatalysatorer, der er afgørende for nedbrydningen af tangbiomasse i havene. For første gang, et internationalt hold af 19 forskere afkodede for nylig den komplette nedbrydningsvej for
Forskerhold dechifrerer enzymatisk nedbrydning af sukker fra marine algerEnzymer er biokatalysatorer, der er afgørende for nedbrydningen af tangbiomasse i havene. For første gang, et internationalt hold af 19 forskere afkodede for nylig den komplette nedbrydningsvej for -
 Nye forskningsresultater kan føre til sikrere og mere kraftfulde lithium-ion-batterierKredit:CC0 Public Domain Virginia Commonwealth University-forskere arbejder på at forbedre ledningsevne og sikkerhed i lithium-ion-batterier, som bruges til at drive mange elektroniske enheder run
Nye forskningsresultater kan føre til sikrere og mere kraftfulde lithium-ion-batterierKredit:CC0 Public Domain Virginia Commonwealth University-forskere arbejder på at forbedre ledningsevne og sikkerhed i lithium-ion-batterier, som bruges til at drive mange elektroniske enheder run -
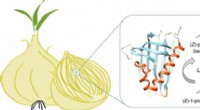 Den nitty-gritty bag hvordan løg får dig til at grædeKredit:American Chemical Society Tilføjelse af løg til en opskrift kan få et måltid til at smage rig og velsmagende, men at skære løget kan være brutalt. Løg frigiver en forbindelse kaldet lachrym
Den nitty-gritty bag hvordan løg får dig til at grædeKredit:American Chemical Society Tilføjelse af løg til en opskrift kan få et måltid til at smage rig og velsmagende, men at skære løget kan være brutalt. Løg frigiver en forbindelse kaldet lachrym


