Hvad gør noget til en stærk syre?
Her er en oversigt over de vigtigste faktorer:
* Komplet ionisering: Stærke syrer adskiller 100% i opløsning og frigiver alle deres brintioner. Dette er i modsætning til svage syrer, som kun delvis ioniserer.
* Høj koncentration af H+ -ioner: Den komplette ionisering af stærke syrer fører til en høj koncentration af H+ -ioner, hvilket er det, der definerer surhedsgrad.
* Lav pH: PH -skalaen måler surhedsgrad. Stærke syrer har meget lave pH -værdier (typisk under 3), hvilket indikerer en høj koncentration af H+ -ioner.
* stærk konjugatbase: Den konjugatbase af en stærk syre er meget svag og accepterer ikke let H+ -ioner tilbage. Dette sikrer, at syren forbliver fuldt ioniseret i opløsning.
Eksempler på stærke syrer:
* saltsyre (HCL): En af de mest almindelige stærke syrer, der blev brugt i forskellige industrielle og laboratorieapplikationer.
* svovlsyre (H2SO4): En meget ætsende syre, der anvendes til produktion af gødning, batterier og andre kemikalier.
* salpetersyre (HNO3): En stærk oxiderende syre, der anvendes til produktion af gødning, sprængstoffer og andre kemikalier.
Sammenfattende er en stærk syre et stof, der let og fuldstændigt frigiver brintioner i opløsning, hvilket resulterer i en høj koncentration af H+ -ioner, lav pH og en svag konjugatbase.
 Varme artikler
Varme artikler
-
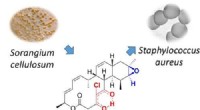 Antimikrobielt naturprodukt, der er aktivt mod både MRSA og malariaforårsagende parasitAnaloger af det naturlige produkt chlorotonil blev opnået ved semisyntese gennem regio- og stereoselektiv epoxidation og efterfølgende ringåbning. Derivaterne bibeholdt aktivitet mod multiresistente g
Antimikrobielt naturprodukt, der er aktivt mod både MRSA og malariaforårsagende parasitAnaloger af det naturlige produkt chlorotonil blev opnået ved semisyntese gennem regio- og stereoselektiv epoxidation og efterfølgende ringåbning. Derivaterne bibeholdt aktivitet mod multiresistente g -
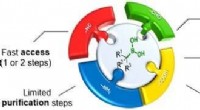 Lille volumen, høj-throughput organisk synteseByggestenstilgang til at forberede kompleks ─B(OH) 2 del indeholdende molekyler i stort antal. Kredit:Dömling Lab/Science Advances Universitetet i Groningen professor i lægemiddeldesign, Alexand
Lille volumen, høj-throughput organisk synteseByggestenstilgang til at forberede kompleks ─B(OH) 2 del indeholdende molekyler i stort antal. Kredit:Dömling Lab/Science Advances Universitetet i Groningen professor i lægemiddeldesign, Alexand -
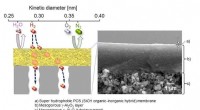 Ny brintbrændstofrensningsmembran baner vejen for en grønnere fremtidEt tværsnitsbillede af selektiv hydrogengennemtrængning i en superhydrofob membran dannet på en porøs rørformet understøtning. Kredit:Yuji Iwamoto fra Nagoya Institute of Technology Brint er bleve
Ny brintbrændstofrensningsmembran baner vejen for en grønnere fremtidEt tværsnitsbillede af selektiv hydrogengennemtrængning i en superhydrofob membran dannet på en porøs rørformet understøtning. Kredit:Yuji Iwamoto fra Nagoya Institute of Technology Brint er bleve -
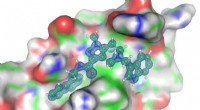 Ny terapeutisk strategi mod sovesygeStruktur af grænsefladen mellem PEX14 og PEX5 (bagpå) inklusive strukturen af inhibitoren (foran). Kredit:Dr. Grzegorz Popowicz, Helmholtz Zentrum München Et nyudviklet lille molekyle dræber sel
Ny terapeutisk strategi mod sovesygeStruktur af grænsefladen mellem PEX14 og PEX5 (bagpå) inklusive strukturen af inhibitoren (foran). Kredit:Dr. Grzegorz Popowicz, Helmholtz Zentrum München Et nyudviklet lille molekyle dræber sel
- Hvordan kan vi evaluere kvaliteten af globale vandmodeller?
- Undersøgelse afslører ubalance i byplanlægning af grønne områder fører til alvorlige uligheder…
- En voltaisk celle er lavet af kobber- og aluminiumselektroder Hvad EMF denne celle?
- Hvilken enhed bruges til at måle en planet?
- Et andet Higgs-rygte minder os om, hvordan videnskab er korrekt udført
- Den kemiske sammensætning af udåndet luft fra humane lunger


