Hvad er en videnskabelig forbindelse?
Her er en sammenbrud af vigtige aspekter:
1. Elementer: Forbindelser består af elementer, som er de enkleste rene stoffer. Disse elementer findes på den periodiske tabel. For eksempel er vand (H₂O) en forbindelse fremstillet af elementerne brint (H) og ilt (O).
2. Kemisk binding: Elementer i en forbindelse holdes sammen af kemiske bindinger, som er tiltrækningskræfter mellem atomer. Disse bindinger kan være ioniske (overførsel af elektroner) eller kovalente (deling af elektroner).
3. Fast forhold: Elementerne i en forbindelse kombineres altid i et fast forhold. Dette betyder, at den samme forbindelse altid vil have de samme proportioner af hvert element. For eksempel vil vand altid have to hydrogenatomer til hvert iltatom, uanset mængden af vand.
4. Nye egenskaber: Forbindelser har forskellige egenskaber end de elementer, der udgør dem. For eksempel er natrium (NA) et blødt, reaktivt metal, og chlor (CL) er en giftig gas. Men når de kombineres til dannelse af natriumchlorid (NaCl), danner de bordsalt, et fast stof med et helt andet sæt egenskaber.
Eksempler på forbindelser:
* vand (H₂O)
* salt (NaCl)
* sukker (c₁₂h₂₂o₁₁)
* kuldioxid (co₂)
* ammoniak (nh₃)
Nøglepunkter:
* Forbindelser dannes af kemiske reaktioner.
* Forbindelser kan opdeles i deres bestanddele af kemiske reaktioner.
* Forbindelser har en bestemt kemisk formel.
* Forbindelser har unikke egenskaber, der er forskellige fra deres bestanddele.
Fortæl mig, hvis du har andre spørgsmål om videnskabelige forbindelser.
 Varme artikler
Varme artikler
-
 Forskere designer ny metabolisk teknologi for at åbne videnskabelige data for alleKredit:CC0 Public Domain Patienter ønsker at se deres medicinske oplysninger. Forskere vil gerne dele deres data. Nu, forskere ved Scripps Research har frigivet en ny teknologi designet til at gø
Forskere designer ny metabolisk teknologi for at åbne videnskabelige data for alleKredit:CC0 Public Domain Patienter ønsker at se deres medicinske oplysninger. Forskere vil gerne dele deres data. Nu, forskere ved Scripps Research har frigivet en ny teknologi designet til at gø -
 Styring af termisk ledningsevne af polymerer med lysUnder omgivelsesbetingelser eller synligt lys (venstre side), polymeren er krystallinsk og har en høj varmeledningsevne. Når den er udsat for ultraviolet (UV) lys (højre side), omdannes den til en væs
Styring af termisk ledningsevne af polymerer med lysUnder omgivelsesbetingelser eller synligt lys (venstre side), polymeren er krystallinsk og har en høj varmeledningsevne. Når den er udsat for ultraviolet (UV) lys (højre side), omdannes den til en væs -
 Kunstig fotosyntese får et stort løft fra ny katalysatorPhil De Luna er en af hovedforfatterne til et nyt papir offentliggjort i Nature Chemistry, der rapporterer en lavpris, højeffektiv katalysator til kemisk omdannelse af vand til oxygen. Katalysatoren
Kunstig fotosyntese får et stort løft fra ny katalysatorPhil De Luna er en af hovedforfatterne til et nyt papir offentliggjort i Nature Chemistry, der rapporterer en lavpris, højeffektiv katalysator til kemisk omdannelse af vand til oxygen. Katalysatoren -
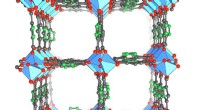 I ørkenforsøg, næste generations vandopsamler leverer frisk vand fra luftenKrystalstrukturen af de nyeste, aluminiumsbaseret metal-organisk ramme, MOF-303, som fanger dobbelt så meget vand som den tidligere MOF, der blev brugt i vandhøsteren. Kredit:Yaghi lab, UC Berkeley
I ørkenforsøg, næste generations vandopsamler leverer frisk vand fra luftenKrystalstrukturen af de nyeste, aluminiumsbaseret metal-organisk ramme, MOF-303, som fanger dobbelt så meget vand som den tidligere MOF, der blev brugt i vandhøsteren. Kredit:Yaghi lab, UC Berkeley


