Hvorfor er strukturen af 2 ikke lineær?
1. Elektronegativitet: Oxygen er mere elektronegativ end fluor. Dette betyder, at iltatomet tiltrækker de delte elektroner i O-F-bindingerne stærkere, hvilket resulterer i en delvis negativ ladning på ilt og en delvis positiv ladning på fluoratomerne.
2. Ensomme par: Oxygen har to ensomme par elektroner i sin valensskal. Disse ensomme par udøver en stærk frastødende kraft på bindingsparene af elektroner i O-F-bindingerne.
3. VSEPR -teori: I henhold til Valence Shell Electron Pair Repulsion (VSEPR) -teorien, elektronpar, både binding og ikke-bonding, prøver at minimere frastødning ved at placere sig så langt fra hinanden som muligt. I tilfælde af 2 , det optimale arrangement til at minimere frastødning er en bøjet form med en bindingsvinkel på cirka 103,3 grader.
Derfor fører kombinationen af ilts elektronegativitet og tilstedeværelsen af ensomme par på ilt til den bøjede form af 2 snarere end en lineær struktur.
Sidste artikelHvordan reagerer mønt med syre?
Næste artikelHvad er forskellen mellem univalent og multivalent?
 Varme artikler
Varme artikler
-
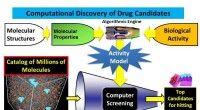 Algoritme fører til en dramatisk forbedring i lægemiddelopdagelsesmetoderBeregningsmæssig opdagelse af lægemiddelkandidater. Kredit:Amiram Goldblum Antibiotika til behandling af særligt resistente sygdomme, molekyler, der blokerer immunsystemets overreaktioner, molekyl
Algoritme fører til en dramatisk forbedring i lægemiddelopdagelsesmetoderBeregningsmæssig opdagelse af lægemiddelkandidater. Kredit:Amiram Goldblum Antibiotika til behandling af særligt resistente sygdomme, molekyler, der blokerer immunsystemets overreaktioner, molekyl -
 Kunstig anti-oxidant kan være det næste supplementGino DiLabio er professor og leder af Institut for Kemi på UBC Okanagan Kredit:UBC Okanagan Naturligt afledte antioxidanter er blevet it sundhedsingrediensen at kigge efter i mad. Men forskere fra
Kunstig anti-oxidant kan være det næste supplementGino DiLabio er professor og leder af Institut for Kemi på UBC Okanagan Kredit:UBC Okanagan Naturligt afledte antioxidanter er blevet it sundhedsingrediensen at kigge efter i mad. Men forskere fra -
 En katalytisk balancegang for opdeling af vand i hydrogen og iltArgonne -forskere og deres samarbejdspartnere har brugt en ny og kontraintuitiv tilgang til at afbalancere tre vigtige faktorer - aktivitet, stabilitet og ledningsevne - i en ny katalysator designet t
En katalytisk balancegang for opdeling af vand i hydrogen og iltArgonne -forskere og deres samarbejdspartnere har brugt en ny og kontraintuitiv tilgang til at afbalancere tre vigtige faktorer - aktivitet, stabilitet og ledningsevne - i en ny katalysator designet t -
 Ny undersøgelse sætter usædvanlig retsmedicinsk efterforskningsteknik på prøveByrne testede slim blandet med reagenskemikalier for at afgøre, om blandingen var effektiv til at afsløre svære at se fingeraftryk. Kredit:Leanne Byrne Kunne husholdningsslim blive et værktøj til
Ny undersøgelse sætter usædvanlig retsmedicinsk efterforskningsteknik på prøveByrne testede slim blandet med reagenskemikalier for at afgøre, om blandingen var effektiv til at afsløre svære at se fingeraftryk. Kredit:Leanne Byrne Kunne husholdningsslim blive et værktøj til
- Forskellen mellem Geoid & Ellipsoid
- 2D-materialer mister lettere varme, når de er indkapslet
- Vil momentumet af et system ændre sig, når nettokraften virker på systemet?
- Hvad er teorier om vandhydrering en forbindelse?
- Hvordan et gammelt hvirveldyr bruger velkendte værktøjer til at bygge et mærkeligt udseende hoved…
- Hvad er olitterensen mellem isolering og jordbaseret stråling?


