Hvad sker der, når natriumatomer reagerer med jod?
reaktionen:
* natrium (NA) er et meget reaktivt alkalimetal. Det mister let en elektron for at opnå en stabil elektronkonfiguration.
* jod (i₂) er en ikke -metal, der let får en elektron for at opnå en stabil elektronkonfiguration.
Når natrium- og jod samles, overfører natriumatomerne deres valenselektroner til iodatomerne. Dette skaber ioniske obligationer , hvor de positivt ladede natriumioner (Na⁺) tiltrækkes af de negativt ladede iodidioner (I⁻).
Ligningen:
Den afbalancerede kemiske ligning for denne reaktion er:
2 Na + I₂ → 2 NAI
Nøglepunkter:
* eksotermisk reaktion: Reaktionen mellem natrium og jod frigiver energi i form af varme og lys, hvilket gør det til en eksoterm reaktion.
* Dannelse af ionisk forbindelse: Produktet, natriumiodid, er en ionisk forbindelse. Ioniske forbindelser dannes af den elektrostatiske tiltrækning mellem modsat ladede ioner.
* Elektronoverførsel: Reaktionen involverer overførsel af elektroner fra natrium til jod. Denne overførsel af elektroner er det, der driver dannelsen af den ioniske binding.
Sikkerhedsforholdsregler:
* Natrium er et meget reaktivt metal og reagerer voldsomt med vand. Det skal håndteres med ekstrem omhu.
* Jod er et ætsende stof og kan forårsage hudirritation.
* Det er vigtigt at bære passende sikkerhedsudstyr, såsom handsker og beskyttelsesbriller, når du håndterer disse stoffer.
Anvendelser af natriumiodid:
Natriumiodid har forskellige anvendelser, herunder:
* Medicinsk billeddannelse: Natriumiodid bruges til produktion af radioaktivt jod, der bruges til medicinsk billeddannelse.
* saltstatus: Iodiseret salt er en almindelig kilde til diætjod, hvilket er vigtigt for korrekt skjoldbruskkirtelfunktion.
* Industrielle anvendelser: Natriumiodid bruges også i forskellige industrielle anvendelser, såsom produktion af farvestoffer og fotografiske kemikalier.
 Varme artikler
Varme artikler
-
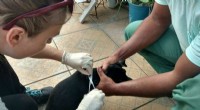 Elektronisk næse til at snuse hunde for dødelig tropesygdom i BrasilienTager hårprøver. Kredit:Lancaster University Færre hunde i Brasilien kan blive aflivet unødigt, efter at forskere har vist, at en ny test er 95 procent nøjagtig til at identificere den dødelige sy
Elektronisk næse til at snuse hunde for dødelig tropesygdom i BrasilienTager hårprøver. Kredit:Lancaster University Færre hunde i Brasilien kan blive aflivet unødigt, efter at forskere har vist, at en ny test er 95 procent nøjagtig til at identificere den dødelige sy -
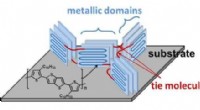 Uvridende plastik til opladning af Internet-of-Things-enhederTil venstre:Forskerne fandt ud af, at deres dopingteknik dannede bindinger (røde) mellem PBTTTs krystallinske dele (blå rektangler). Til højre:De fandt også ud af, at PBTTT var snoet i sin naturlige t
Uvridende plastik til opladning af Internet-of-Things-enhederTil venstre:Forskerne fandt ud af, at deres dopingteknik dannede bindinger (røde) mellem PBTTTs krystallinske dele (blå rektangler). Til højre:De fandt også ud af, at PBTTT var snoet i sin naturlige t -
 Hvordan man bygger kunstige nanofabrikker til at drive vores fremtidSkibe hjælper med at håndtere den komplekse logistik for at levere produkter til forbrugerne. Fremtidige kunstige nanofabrikker vil også have brug for en kæde af logistiske nano-køretøjer til at lever
Hvordan man bygger kunstige nanofabrikker til at drive vores fremtidSkibe hjælper med at håndtere den komplekse logistik for at levere produkter til forbrugerne. Fremtidige kunstige nanofabrikker vil også have brug for en kæde af logistiske nano-køretøjer til at lever -
 Hvorfor løg får os til at græde (og hvorfor nogle ikke gør det)Kredit:Shutterstock Mark Anthony i Shakespeares Cleopatra kan have henvist til tårerne, der lever i løget. Men hvorfor får løg os egentlig til at græde? Og hvorfor er det kun nogle løg, der får os
Hvorfor løg får os til at græde (og hvorfor nogle ikke gør det)Kredit:Shutterstock Mark Anthony i Shakespeares Cleopatra kan have henvist til tårerne, der lever i løget. Men hvorfor får løg os egentlig til at græde? Og hvorfor er det kun nogle løg, der får os
- Hvad er to ting, der udgør et områder klima?
- NASA øjner ekstremt alvorlige cykloniske mekunu, der nærmer sig landgang
- Hvilket element er kulilte?
- Molekylære motorer:Effekt meget mindre end forventet?
- Hvor mange liter dieselbrændstof er i 207538 pund brændstof?
- Kartofler for fred:hvordan den ydmyge knold stoppede konflikten i Europa


