Type limning af vandmolekyler udstiller?
Her er hvorfor:
* polære kovalente obligationer: Oxygenatomet i et vandmolekyle (H₂O) er mere elektronegativt end hydrogenatomerne. Dette betyder, at iltatomet tiltrækker de delte elektroner i de kovalente bindinger stærkere, hvilket skaber en delvis negativ ladning (Δ-) på ilt- og delvis positive ladninger (Δ+) på hydrogenerne.
* Hydrogenbinding: De delvist positive hydrogenatomer i et vandmolekyle tiltrækkes af det delvist negative iltatom i et andet vandmolekyle. Denne attraktion kaldes en brintbinding.
Hydrogenbindinger er svagere end kovalente bindinger, men påvirker stadig væsentligt vandets egenskaber, såsom dets:
* Højt kogepunkt: Hydrogenbindinger kræver en masse energi til at bryde, hvilket fører til et højere kogepunkt end forventet for et molekyle af dens størrelse.
* Høj overfladespænding: Hydrogenbindinger skaber en stærk sammenhængende kraft mellem vandmolekyler, hvilket resulterer i en høj overfladespænding.
* Evne til at opløse mange stoffer: Hydrogenbindinger kan dannes med mange andre molekyler, hvilket gør det muligt for vand at opløse en lang række stoffer.
Fortæl mig, hvis du gerne vil have mere information om hydrogenbinding eller et andet aspekt af vandets egenskaber!
 Varme artikler
Varme artikler
-
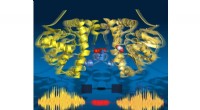 En molekylær strengtelefon på arbejdeTime-lapse-billeder viser, at enzymet ånder under omsætning:det udvider sig og trækker sig sammen i overensstemmelse med de katalytiske undertrin. Dens to halvdele kommunikerer via en række vandmoleky
En molekylær strengtelefon på arbejdeTime-lapse-billeder viser, at enzymet ånder under omsætning:det udvider sig og trækker sig sammen i overensstemmelse med de katalytiske undertrin. Dens to halvdele kommunikerer via en række vandmoleky -
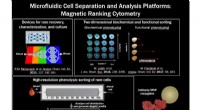 Enkeltcellet mRNA-cytometri via sekvensspecifik nanopartikelklyngning og fangstForskere fra University of Toronto udviklede en flydende biopsiteknologi til at forbedre behandlingen af prostatacancer. Kredit:University of Toronto Prostatakræft er den næsthyppigste kræftsygd
Enkeltcellet mRNA-cytometri via sekvensspecifik nanopartikelklyngning og fangstForskere fra University of Toronto udviklede en flydende biopsiteknologi til at forbedre behandlingen af prostatacancer. Kredit:University of Toronto Prostatakræft er den næsthyppigste kræftsygd -
 Gør ammoniak grønnereGrafisk illustration, der viser protoneret vand, der reagerer med nitrogenmolekyler for at danne ammoniak ved en plasma-væske-grænseflade. Kredit:Case Western Reserve University Ammoniak, en forbi
Gør ammoniak grønnereGrafisk illustration, der viser protoneret vand, der reagerer med nitrogenmolekyler for at danne ammoniak ved en plasma-væske-grænseflade. Kredit:Case Western Reserve University Ammoniak, en forbi -
 Subtilitet og den selektive kunst at adskille lanthaniderEt ekstraktionsmiddel fjerner et element fra et hav af lignende. Forskere opdagede et ejendommeligt arrangement af vandmolekyler i den ydre sfære (røde og hvide kugler) omkring et ekstraktionsmiddel (
Subtilitet og den selektive kunst at adskille lanthaniderEt ekstraktionsmiddel fjerner et element fra et hav af lignende. Forskere opdagede et ejendommeligt arrangement af vandmolekyler i den ydre sfære (røde og hvide kugler) omkring et ekstraktionsmiddel (
- Forskere finder kilden til gammastråler i en lille nabogalakse
- Mælkebøtte ønsker at spille en rolle i hjemmets geotermi
- Ny vej til kulstofneutrale brændstoffer fra kuldioxid opdaget
- Hvad lærer 7. studerende i videnskab?
- Har gasgiganter en fast overflade eller består de udelukkende af gas?
- Gør det nemmere at differentiere spejlbillede-molekyler


