En molekylær strengtelefon på arbejde
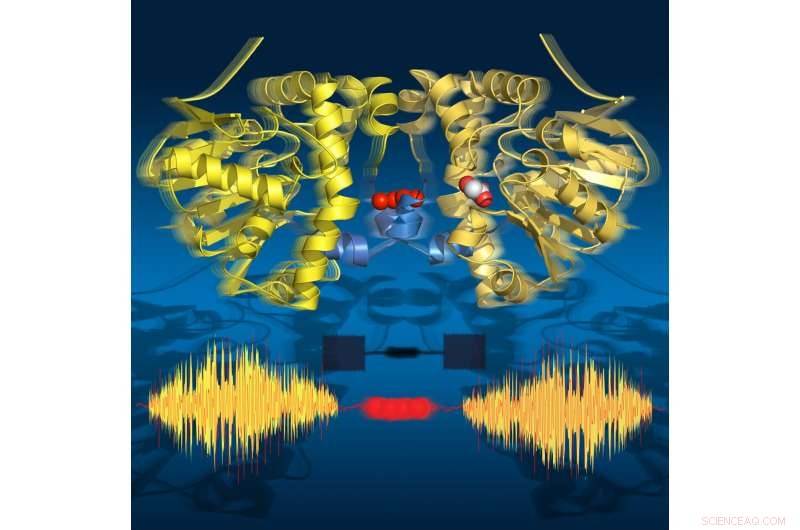
Time-lapse-billeder viser, at enzymet 'ånder' under omsætning:det udvider sig og trækker sig sammen i overensstemmelse med de katalytiske undertrin. Dens to halvdele kommunikerer via en række vandmolekyler. Kredit:Joerg M. Harms, MPSD
Forskere fra Department of Atomically Resolved Dynamics ved Max Planck Institute for the Structure and Dynamics of Matter (MPSD) ved Center for Free-Electron Laser Science i Hamborg, University of Potsdam (begge i Tyskland) og University of Toronto (Canada) har sammensat en detaljeret time-lapse-film, der afslører alle de store trin i et enzyms katalytiske cyklus. Overraskende nok, kommunikationen mellem proteinenhederne sker via et vandnetværk, der ligner en strengtelefon. Denne kommunikation er afstemt med en 'åndedræt'-bevægelse, det er udvidelsen og sammentrækningen af proteinet. Denne time-lapse-sekvens af strukturer afslører dynamiske bevægelser som et grundlæggende element i biologiens molekylære grundlag.
Alt liv er dynamisk, og det er dets molekylære byggesten også. Biomolekylers bevægelser og strukturelle ændringer er grundlæggende for deres funktioner. Imidlertid, at forstå disse dynamiske bevægelser på et molekylært niveau er en formidabel udfordring. Hvordan er et protein i stand til at fremskynde en kemisk reaktion, som ville tage år at fortsætte uden hjælp?
Til dette formål henvendte forskerne sig til et enzym, der splitter den stærkeste enkeltbinding i organisk kemi:C-F-bindingen. Fluorerede kulstoffer kan findes i materialer som Teflon eller GoreTex og i mange lægemidler og pesticider. Fluorerede forbindelser har en særlig indflydelse på klimaændringer, overstiger effektiviteten af CO 2 i størrelsesorden. Derfor, Evnen til bedre at forstå og i sidste ende kontrollere omsætningen af C-F-obligationer er af særlig interesse for klimaændringer og bioremediering.
Forskerne brugte tidsopløst røntgenkrystallografi til at tage molekylære snapshots under omsætningsreaktionen af dette naturlige enzym ved fysiologiske temperaturer. Denne time-lapse-film afslørede atten tidspunkter fra 30 millisekunder til 30 sekunder, dækker alle nøglekatalytiske tilstande, der fører til brud på C-F-bindingen. Overraskende nok, filmen viser også, at enzymet 'ånder' under omsætning, det vil sige, at den udvider sig og trækker sig sammen i overensstemmelse med de katalytiske undertrin.
Påfaldende nok, de to halvdele af enzymet kommunikerer med hinanden via en streng af vandmolekyler, der forbinder begge halvdele. Dette vandnetværk giver de to halvdele mulighed for at 'tale' med hinanden og dele information om deres katalytiske tilstand. Dette er afgørende for enzymets funktion, da kun den ene halvdel af enzymet nogensinde kan være aktiv på et givet tidspunkt.
Disse dynamiske ændringer har vist sig at være afgørende for enzymets funktion. Forskerne forventer, at mange andre systemer udnytter lignende mekanismer til deres aktiviteter.
 Varme artikler
Varme artikler
-
 San Antonio-forskere søger at forhindre luft- og rumfartsfejl og katastrofer med olieudslipProfessor Troconis vil studere brintskørhed på molekylært niveau for at se, hvordan brintatomernes placering påvirker metalmaterialets integritet under de høje tryk og forhøjede temperaturer, der er t
San Antonio-forskere søger at forhindre luft- og rumfartsfejl og katastrofer med olieudslipProfessor Troconis vil studere brintskørhed på molekylært niveau for at se, hvordan brintatomernes placering påvirker metalmaterialets integritet under de høje tryk og forhøjede temperaturer, der er t -
 Gennembrudende retsmedicinsk tilgang til at hjælpe med at slå ned på salget af falske stofferKredit:CC0 Public Domain Falske lægemidler er et af de største sundhedsproblemer i verden i dag. Den internationale kriminalpolitiorganisation (INTERPOL) oplevede en stigning i falske medicinske
Gennembrudende retsmedicinsk tilgang til at hjælpe med at slå ned på salget af falske stofferKredit:CC0 Public Domain Falske lægemidler er et af de største sundhedsproblemer i verden i dag. Den internationale kriminalpolitiorganisation (INTERPOL) oplevede en stigning i falske medicinske -
 Forstå en celles dørklokkeFremme af design af lægemidler til bedre medicinske effekter kræver en kombination af eksperimentel og computersimuleringsforskning. Forskere ved Los Alamos National Laboratory, University of Toronto,
Forstå en celles dørklokkeFremme af design af lægemidler til bedre medicinske effekter kræver en kombination af eksperimentel og computersimuleringsforskning. Forskere ved Los Alamos National Laboratory, University of Toronto, -
 Kunstige materialer rekonstruerer marsvins ekkolokaliseringDesignet af den fysisk baserede fysiske model Kredit:©Science China Press Over millioner af år, Marsvin har udviklet kraftfulde biosonarer med høj nøjagtighed og intelligens til at detektere og sp
Kunstige materialer rekonstruerer marsvins ekkolokaliseringDesignet af den fysisk baserede fysiske model Kredit:©Science China Press Over millioner af år, Marsvin har udviklet kraftfulde biosonarer med høj nøjagtighed og intelligens til at detektere og sp
- Hvordan frygt for kriminalitet, kulturel angst og køn former våbenejerskab
- Geofysiker spurter for at overvåge jordskælv efterskælv i Alaska
- Forvandling af vand til is i kvanteriget (Opdatering)
- Forskere opdager, at nøglen til sikrere batterier ligger på overfladen
- Sådan konverteres decimaler til fødder, tommer og brud på en tomme <p> <p> For folk i USA, når d…
- Sodtransport bidrager kun lidt til smeltningen af nogle antarktiske gletsjere


