Den bindende energi af elektroner i et metal er 178 kJ pr. Mol Hvad tærskelfrekvensen?
forståelse af koncepterne
* bindende energi: Den bindende energi er den minimale mængde energi, der kræves for at fjerne et elektron fra en metaloverflade.
* Tærskelfrekvens: Den minimale lysfrekvens, der kan forårsage fotoemission (udsprøjtning af elektroner fra en metaloverflade).
* Fotoelektrisk effekt: Fænomenet, hvor lys kan slå elektroner ud af et metal.
Ligninger
* bindende energi (E) og tærskelfrekvens (v): E =hν
* Hvor:
* E er den bindende energi (i Joules)
* H er Planck's Constant (6.626 x 10⁻³⁴ J S)
* ν er tærskelfrekvensen (i Hz)
Beregninger
1.
* 178 kJ/mol =178.000 j/mol
* Del med Avogadros nummer (6.022 x 10²³ atomer/mol) for at få energi pr. Atom:
178.000 j/mol/6,022 x 10²³ atomer/mol =2,96 x 10⁻¹⁹ j/atom
2. Beregn tærskelfrekvens:
* Omarranger ligningen:v =e/h
* Tilslut værdierne:v =(2,96 x 10⁻¹⁹ J) / (6,626 x 10⁻³⁴ J S)
* Beregn:v ≈ 4,46 x 10¹⁴ Hz
Svar
Tærskelfrekvensen for dette metal er cirka 4,46 x 10¹⁴ Hz .
 Varme artikler
Varme artikler
-
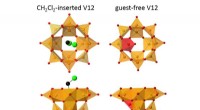 Flipped metaloxidbur kan sortere kuldioxid fra kulilteAnionstrukturer af CH 2 Cl 2 (gæst)-indsat V12 (venstre) og gæstefri V12 er vist. Orange og røde firkantede pyramider repræsenterer VO 5 enheder med deres baser rettet mod midten af skålen, og
Flipped metaloxidbur kan sortere kuldioxid fra kulilteAnionstrukturer af CH 2 Cl 2 (gæst)-indsat V12 (venstre) og gæstefri V12 er vist. Orange og røde firkantede pyramider repræsenterer VO 5 enheder med deres baser rettet mod midten af skålen, og -
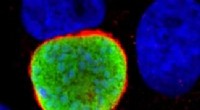 Malaria kaprer dine gener for at invadere din leverI de tidlige stadier af infektion, malariaparasitten (grøn) gemmer sig i en persons leverceller (blå), før den invaderer deres blod. Vist med rødt er et menneskeligt protein, som parasitten co-opterer
Malaria kaprer dine gener for at invadere din leverI de tidlige stadier af infektion, malariaparasitten (grøn) gemmer sig i en persons leverceller (blå), før den invaderer deres blod. Vist med rødt er et menneskeligt protein, som parasitten co-opterer -
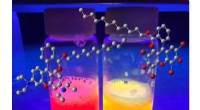 Lab producerer simple fluorescerende overfladeaktive stofferRice University kemikere har produceret en række fluorescerende overfladeaktive stoffer til billeddannelse, biomedicinske og fremstillingsapplikationer. Kredit:Ashleigh Smith McWilliams/Rice Universit
Lab producerer simple fluorescerende overfladeaktive stofferRice University kemikere har produceret en række fluorescerende overfladeaktive stoffer til billeddannelse, biomedicinske og fremstillingsapplikationer. Kredit:Ashleigh Smith McWilliams/Rice Universit -
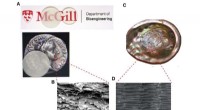 Ubrydeligt glas inspireret af muslingeskaller(A) Glaskomposit (uden indeksmatchingsstrategi til venstre og med indeksmatchning til højre), (B) Glaskomposits mikrostruktur, (C) Udsigt over det nacreøse lag i rød abalone shell, og (D) Nacres mikro
Ubrydeligt glas inspireret af muslingeskaller(A) Glaskomposit (uden indeksmatchingsstrategi til venstre og med indeksmatchning til højre), (B) Glaskomposits mikrostruktur, (C) Udsigt over det nacreøse lag i rød abalone shell, og (D) Nacres mikro
- Forskere forbedrer katalysatoren, der ødelægger kemikalier for evigt med sollys
- Belastningsdrevet autonom kontrol af kationfordeling til kunstig ferroelektrik
- Ingeniører viser, hvordan en autonom, drifting DeLorean kan forbedre førersikkerheden
- Hvad absorberer røntgenbølger?
- Molekylært jod katalyserer processer til antivirale og farmaceutiske synteser
- 6 Forklar, hvorfor evolution ved naturlig selektion ikke kan forekomme, hvis variationen i en egensk…


