Hvilken elektronadfærd i forbindelser findes brint?
1. Kovalent binding:
* Deling af elektroner: I de fleste forbindelser danner brintformer kovalente bindinger , hvor det deler sin enkelte elektron med et andet atom. Denne deling skaber en stabil, fyldt elektronskal til begge atomer.
* polære kovalente obligationer: Når brintbindinger med et mere elektronegativt atom, som ilt eller nitrogen, trækkes de delte elektroner tættere på det mere elektronegative atom. Dette skaber en polær kovalent binding hvor brint udvikler en delvis positiv ladning (Δ+), og det andet atom udvikler en delvis negativ ladning (Δ-).
2. Ionisk binding:
* taber elektroner: I nogle tilfælde kan brint miste sin elektron Helt til dannelse af A brintkation (H+) . Dette forekommer normalt, når brint er bundet til et stærkt elektronegativt element som halogenerne (fluor, chlor, brom, jod).
Eksempler:
* vand (H2O): Hydrogen danner polære kovalente bindinger med ilt, der deler dets elektron for at danne et stabilt molekyle. Oxygenatomet tiltrækker de delte elektroner stærkere, hvilket giver det en delvis negativ ladning, mens brintatomerne har delvis positive ladninger.
* methan (CH4): Hydrogen danner ikke-polære kovalente bindinger med kulstof, der deler dens elektron lige for at skabe et stabilt molekyle.
* hydrogenchlorid (HCL): Her mister brint sit elektron til klor, bliver en brintkation (H+) og efterlader klor med en negativ ladning (CL-). Dette danner en ionisk forbindelse.
Særlige egenskaber:
* Hydrogenbinding: Den delvise positive ladning på brint i polære kovalente bindinger giver det mulighed for at danne brintbindinger med andre elektronegative atomer, som ilt eller nitrogen. Disse bindinger er svagere end kovalente bindinger, men er afgørende for mange biologiske og kemiske processer.
Sammenfattende kan Hydrogens elektronadfærd i forbindelser være kendetegnet ved dens evne til at:
* Del elektroner I kovalente bindinger, danner både polære og ikke-polære bindinger.
* mister sin elektron At danne en brintkation (H+) i ioniske forbindelser.
* Deltag i hydrogenbinding På grund af dets delvise positive ladning i polære kovalente bindinger.
Disse forskellige adfærd gør brint til et nøgleelement i en lang række forbindelser.
Sidste artikelHvad hedder gasvandet?
Næste artikelHvad er navnene på listesalte i kemi?
 Varme artikler
Varme artikler
-
 Nobelprisen for banebrydende måde at bygge molekyler på, der gjorde kemi grønnereList (til venstre) og MacMillan (til højre) er vindere af Nobelprisen i kemi i 2021. Kredit:NobelPrize.org, CC BY-SA Benjamin List og David MacMillan, fra henholdsvis Tyskland og USA, vil dele de
Nobelprisen for banebrydende måde at bygge molekyler på, der gjorde kemi grønnereList (til venstre) og MacMillan (til højre) er vindere af Nobelprisen i kemi i 2021. Kredit:NobelPrize.org, CC BY-SA Benjamin List og David MacMillan, fra henholdsvis Tyskland og USA, vil dele de -
 Nye fotoresponsive hydrogeler udviklet med øje for biomedicinske applikationerFotomønsteret falmer fra hydrogel med tiden og udsættelse for luft. (Billede udlånt af Barnes laboratorium) 3-D printet, transplanterbare organer kan lyde som science fiction, men, takket være fre
Nye fotoresponsive hydrogeler udviklet med øje for biomedicinske applikationerFotomønsteret falmer fra hydrogel med tiden og udsættelse for luft. (Billede udlånt af Barnes laboratorium) 3-D printet, transplanterbare organer kan lyde som science fiction, men, takket være fre -
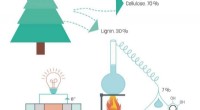 Lignin – et supergrønt brændstof til brændselscellerKredit:Linköping Universitet Forskere fra Laboratory of Organic Electronics ved Linköpings Universitet har udviklet en brændselscelle, der bruger lignin, et billigt biprodukt fra papirfremstilling
Lignin – et supergrønt brændstof til brændselscellerKredit:Linköping Universitet Forskere fra Laboratory of Organic Electronics ved Linköpings Universitet har udviklet en brændselscelle, der bruger lignin, et billigt biprodukt fra papirfremstilling -
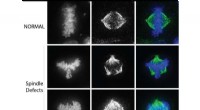 Afdækning af en ny mekanisme i celledelingI kræftceller, defekter i den bipolære spindel fører til at trække kromosomer i flere retninger under celledeling. Kredit:Northwestern University Northwestern Medicine-forskere har afsløret den ro
Afdækning af en ny mekanisme i celledelingI kræftceller, defekter i den bipolære spindel fører til at trække kromosomer i flere retninger under celledeling. Kredit:Northwestern University Northwestern Medicine-forskere har afsløret den ro
- Tilsluttet parallelt hvilken pære vil gløde lysere en 40 watt eller en 100 pære?
- Indstilling af bølgelængden af fluorescerende kulstofrør
- Zero gravity plantevækst eksperimenter leveret til rumstationen
- Fleksibilitet på arbejdspladsen er ikke kun et mødreproblem
- Disse farverige diagrammer viser, hvordan luftkvaliteten har ændret sig i mere end 100 lande siden …
- Neuralt netværk rekonstruerer menneskelige tanker fra hjernebølger i realtid


