Afdækning af en ny mekanisme i celledeling
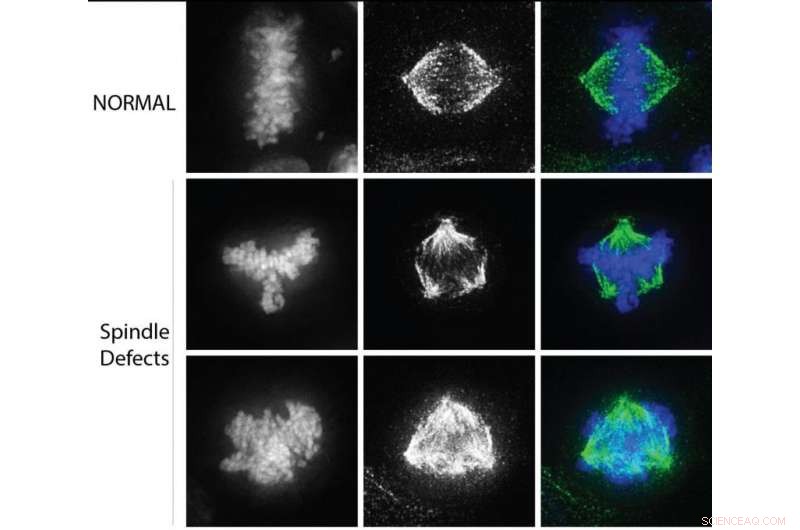
I kræftceller, defekter i den bipolære spindel fører til at trække kromosomer i flere retninger under celledeling. Kredit:Northwestern University
Northwestern Medicine-forskere har afsløret den rolle, aminoterminal methylering spiller i et specifikt protein i centromeren, et område af kromosomet, der er vigtigt for celledeling, og hvordan dysreguleringen af dette protein kan påvirke udviklingen af kræftceller. Methylering af aminosyresidekæder er veldokumenteret, men rollen af aminoterminal methylering er meget mindre godt forstået.
Udgivet i Naturkommunikation , undersøgelsen viste denne posttranslationelle modifikation af proteinet, centromere protein A (CENP-A), adskiller det fra et lignende protein, der findes i resten af kromosomet. CENP-A er en type histon, et protein med DNA viklet omkring det, og angiver placeringen af centromeren i kernen.
Hovedforfatter Daniel Foltz, '01 PhD, lektor i biokemi og molekylær genetik, og hans team udførte funktionelle analyser af ændringerne på CENP-A, som de tidligere havde identificeret.
"Det er interessant, fordi dette er en ny type modifikationer på histoner, og fordi vi kan gå ind og virkelig vise, hvilken funktion der medieres af den aminoterminale methylering, som ikke tidligere har været veldefineret for denne type modifikation, " sagde Foltz.
Efterforskerne opdagede, at CENP-A, når den er korrekt methyleret på dens aminoterminal, påvirker rekrutteringen af CCAN-proteiner, som er en del af et stort centromerkompleks af proteiner. De viste, at en undergruppe af komponenter i CCAN er afhængige af denne methylering. Da forskerne blokerede methylering fra denne proces, de observerede defekter i kromosomadskillelsen.
"Vi definerede virkelig en anden rekrutteringsarm for CCAN-proteinerne, end man har forstået før, " sagde Foltz.
Overekspression af CENP-A i kræft
Næste, forskerne studerede kendetegn ved kræftceller, herunder defekter i kromosomadskillelse og spindelpolaritet. En bipolær spindel er afgørende for ligeligt at adskille kromosomer i to separate celler under celledeling. I kræftceller, defekter i spindlen fører til kromosomer, der trækkes i flere retninger og kan resultere i kromosombrud og genomisk ustabilitet. Forskerne fandt ud af, at reduktion af mængden af methylering af CENP-A driver denne proces.
Foltz og de andre efterforskere fandt også, at i fravær af tumorsuppressorproteinet p53, tab af CENP-A-methylering fremmer hurtigere tumordannelse.
Næste, Foltz og hans team ønsker at studere, hvordan tumorceller bruger denne vej.
"Det, vi har gjort i dette papir, er at konstruere denne defekt i celler for at se, hvad fænotypen er, " sagde Foltz. "Det næste spørgsmål er, hvad der sker med CENP-A-methylering i kræftceller, og når CENP-A er overudtrykt, i hvilken grad driver det den genomiske ustabilitet i kræftformer?"
 Varme artikler
Varme artikler
-
 Molekylær designstrategi afslører nær infrarød-absorberende kulbrinteas-indacenoterrylen er en skålformet forbindelse, der kun er lavet af brint- og kulstofatomer, der kan absorbere nær infrarødt lys. Kredit:Norihito Fukui Nagoya University forskere har syntetisere
Molekylær designstrategi afslører nær infrarød-absorberende kulbrinteas-indacenoterrylen er en skålformet forbindelse, der kun er lavet af brint- og kulstofatomer, der kan absorbere nær infrarødt lys. Kredit:Norihito Fukui Nagoya University forskere har syntetisere -
 Forebyggelse, helbredende huller i tænderne med et bioaktivt peptidKredit:CC0 Public Domain hulrum, eller caries, er den mest udbredte ikke-smitsomme sygdom globalt, ifølge Verdenssundhedsorganisationen. At få boret og fyldt et hulrum på tandlægens kontor kan vær
Forebyggelse, helbredende huller i tænderne med et bioaktivt peptidKredit:CC0 Public Domain hulrum, eller caries, er den mest udbredte ikke-smitsomme sygdom globalt, ifølge Verdenssundhedsorganisationen. At få boret og fyldt et hulrum på tandlægens kontor kan vær -
 Fra rigelige kulbrinter til sjældne spinvæskerFig. 1 Forskelle mellem almindelige magneter og centrifugeringsvæsker. Ved høje temperaturer, spinnene - de små kompasser for hver uparret elektron i materialerne - svinger tilfældigt mellem vilkårlig
Fra rigelige kulbrinter til sjældne spinvæskerFig. 1 Forskelle mellem almindelige magneter og centrifugeringsvæsker. Ved høje temperaturer, spinnene - de små kompasser for hver uparret elektron i materialerne - svinger tilfældigt mellem vilkårlig -
 Forskere får gennembrud inden for lysfangeteknologi til industrielle multikrystallinske siliciumsol…SERIS opfindere, der holder struktureret DWS multikrystallinsk silicium solcelle og skive. Kredit:National University of Singapore Forskere fra Solar Energy Research Institute of Singapore (SERIS)
Forskere får gennembrud inden for lysfangeteknologi til industrielle multikrystallinske siliciumsol…SERIS opfindere, der holder struktureret DWS multikrystallinsk silicium solcelle og skive. Kredit:National University of Singapore Forskere fra Solar Energy Research Institute of Singapore (SERIS)
- Hvordan virker en Magneto?
- Brug af en SN1-reaktion til at lave kvartære stereocentre
- Skovrydning er kun fordrevet under lokalsamfundets overvågningsordninger
- Amazon Prime Day bliver et fænomen, når rivaler springer til
- Spansk brug er konstant eller faldende i USA på trods af høj Latino-immigration
- NASAs Perseverance rover 22 dage fra Mars landing


