Forklar de regler, der bestemmer, hvordan elektroner er arrangeret omkring atomer kerner?
Reglerne for elektronarrangement:
Arrangementet af elektroner omkring et atoms kerne styres af et sæt regler baseret på kvantemekanik. Her er en sammenbrud:
1. Kvantenumre:
* hovedkantenummer (n): Beskriver elektronens energiniveau. Højere 'n' betyder højere energi. Det kan være ethvert positivt heltal (1, 2, 3, ...), hvor 1 er jordtilstanden.
* vinkelmomentum eller azimuthal kvantetal (L): Beskriver formen på elektronens orbital. Det spænder fra 0 til N-1.
* L =0:S Orbital (sfærisk)
* L =1:P orbital (håndvægtformet)
* L =2:D Orbital (mere komplekse former)
* l =3:f orbital (endnu mere komplekse former)
* Magnetisk kvantenummer (ML): Beskriver orienteringen af orbitalen i rummet. Det kan påtage sig værdier fra -l til +l, inklusive 0. Så for l =1 (p orbitaler) er der ml =-1, 0, +1, hvilket giver tre p orbitaler orienteret langs x-, y- og z -akserne.
* spin kvantenummer (MS): Beskriver den iboende vinkelmoment for et elektron, der kvantificeres og visualiseres ofte som elektronet "spinning." Det kan være enten +1/2 eller -1/2.
2. Aufbau -princip:
* Elektroner udfylder orbitaler i rækkefølge af stigende energi.
* Fyldningsordenen er baseret på den diagonale regel (undertiden kaldet Madelung -reglen).
3. Pauli Exclusion Principle:
* Ingen to elektroner i et atom kan have det samme sæt med alle fire kvantetal.
* Dette betyder, at hver orbital maksimalt kan rumme to elektroner med modsatte spins.
4. Hunds regel:
* Inden for et underskal (f.eks. 2P -underskalet) vil elektroner individuelt besætte hver orbital inden for dette underskal, før de parrer sig.
* Dette maksimerer antallet af uparrede elektroner og minimerer elektronelektron-frastødning.
5. Elektronisk konfiguration:
Arrangementet af elektroner i et atom kaldes dets elektroniske konfiguration. Det er skrevet i formularen:
(n) l^(antal elektroner i det underskal)
For eksempel er den elektroniske konfiguration af nitrogen 1S² 2s² 2p³.
Eksempel:
Lad os se på den elektroniske konfiguration af ilt (atomnummer 8):
1. aufbau -princip: Efter den diagonale regel udfylder vi orbitaler i rækkefølgen 1s, 2s, 2p.
2. Pauli Ekskluderingsprincip: Hver orbital kan maksimalt holde to elektroner med modsatte spins.
3. Hunds regel: Inden for underskalet 2P placerer vi et elektron i hver af de tre 2p -orbitaler, før vi parrer op på elektroner.
Derfor er den elektroniske konfiguration af ilt:1S² 2S² 2P⁴
Bemærk: Disse regler giver en ramme for forståelse af, hvordan elektroner distribueres omkring kernen. Imidlertid er elektronernes opførsel kompleks, og kvantemekanik spiller en betydelig rolle i at forklare deres opførsel.
 Varme artikler
Varme artikler
-
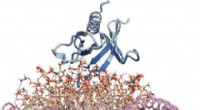 Indsigt på atomniveau opnået for et vigtigt lipidbindende protein impliceret i kræftNanodisk erstatning cellemembran:Protein er blåt, lipider er hvede, og de to spiralformede lipoproteiner, der holder lipid-nanoskiven sammen, er lyserøde. Kredit:Sanford Burnham Prebys Medical Discove
Indsigt på atomniveau opnået for et vigtigt lipidbindende protein impliceret i kræftNanodisk erstatning cellemembran:Protein er blåt, lipider er hvede, og de to spiralformede lipoproteiner, der holder lipid-nanoskiven sammen, er lyserøde. Kredit:Sanford Burnham Prebys Medical Discove -
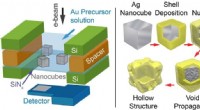 Realtidsbillede af kemiske processer(Venstre) Figur viser en skematisk af in situ LC-TEM opsætningen involverer sølv (Ag) nanokuber i en opløsning af guld (Au) ioner. (Til højre) Mekanisme, der viser den strukturelle transformation unde
Realtidsbillede af kemiske processer(Venstre) Figur viser en skematisk af in situ LC-TEM opsætningen involverer sølv (Ag) nanokuber i en opløsning af guld (Au) ioner. (Til højre) Mekanisme, der viser den strukturelle transformation unde -
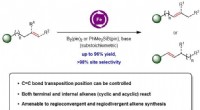 Manipulerer kædevandring i olefiner ved hjælp af jord-rigelige jernbaserede katalysatorerFigur 1:Skematisk viser migration af C =C -bindingen i alkener kan opnås ved hjælp af jernkatalyse med mindre end støkiometriske mængder af en base og borylreagens. Kredit: Journal of the American Che
Manipulerer kædevandring i olefiner ved hjælp af jord-rigelige jernbaserede katalysatorerFigur 1:Skematisk viser migration af C =C -bindingen i alkener kan opnås ved hjælp af jernkatalyse med mindre end støkiometriske mængder af en base og borylreagens. Kredit: Journal of the American Che -
 Fremskridt højtemperaturelektrolyse:Spaltning af vand for at lagre energi som brintKredit:CC0 Public Domain Mens energikilder som vind og sol er gode til at producere emissionsfri elektricitet, de er afhængige af solen og vinden, så udbuddet opfylder ikke altid efterspørgslen. L
Fremskridt højtemperaturelektrolyse:Spaltning af vand for at lagre energi som brintKredit:CC0 Public Domain Mens energikilder som vind og sol er gode til at producere emissionsfri elektricitet, de er afhængige af solen og vinden, så udbuddet opfylder ikke altid efterspørgslen. L
- Hvad er Na3PO4 i kemi?
- Hvorfor er valenselektronerne i metalliske bindinger forskellige fra andre på grund af hvad?
- Design af selektive reaktioner for at modulere biologiske processer
- Hvad er et eksempel på varmeenergi ved konvektion?
- I en F2 -generation havde kun mandlige frugter, der havde hvide øjne, hvad hedder dette arvemønste…
- Afstanden fra Jorden til Constellation Bootes er hvad?


