Forklar, hvordan den specifikke varme af et stof bestemmes?
1. Opsætning:
* kalorimeter: En godt isoleret beholder (som en Styrofoam-kop), der forhindrer varmeudveksling med omgivelserne.
* termometer: For at måle temperaturændringerne.
* Varmeelement: En enhed til at tilføje en kendt mængde varme til stoffet (f.eks. En varmeapparat, en brænder eller en reaktion).
* Stof: Det materiale, hvis specifikke varme du vil finde.
* Kendt vandmasse: Vand bruges ofte som et referencestof på grund af dets veldefinerede specifikke varme.
2. Procedure:
* måle stoffets masse: Du skal kende massen af det stof, du tester.
* Mål den oprindelige temperatur på stoffet: Registrer stoffets starttemperatur i kalorimeteret.
* Tilføj en kendt mængde varme til stoffet: Dette gøres normalt ved at opvarme stoffet direkte eller ved at tilføje en kendt masse varmt vand med en målt temperatur.
* Mål den endelige temperatur på stoffet: Registrer temperaturen, når varmen er tilsat, og systemet når ligevægt.
* Mål temperaturændringen af vandet (hvis relevant): Hvis du brugte varmt vand til at tilføje varme, skal du også måle dens temperaturændring.
3. Beregning:
* Beregn den varme, der er absorberet af stoffet (Q): Dette kan beregnes ved hjælp af følgende formel:
* Q =m * c * ΔT
* Q =varmeenergi (i Joules, J)
* m =stoffet (i gram, g)
* C =specifik varmekapacitet (i joules pr. Gram pr. Grad Celsius, J/G ° C)
* ΔT =Ændring i temperatur (i grader Celsius, ° C)
* Beregn den varme, der er frigivet af det varme vand (hvis relevant): Brug den samme formel som ovenfor, men erstatt massen, specifik varme og temperaturændring af vandet.
* sidestilles med den varme, der absorberes af stoffet med den varme, der er frigivet af det varme vand (hvis relevant): Dette sikrer, at den samlede energi i systemet forbliver konstant.
* Løs for den specifikke varme (c): Omarranger ligningen for at isolere den specifikke varmekapacitet, c.
4. Resultat:
Den beregnede værdi af C er den specifikke varme af stoffet i joules enheder pr. Gram pr. Grad Celsius (J/g ° C).
Eksempel:
Lad os sige, at du vil finde den specifikke varme i en metalprøve. Du placerer 50 gram metallet i et kalorimeter og opvarmer det med 100 gram vand oprindeligt ved 80 ° C. Vandet afkøles til 60 ° C, og metalens temperatur stiger fra 20 ° C til 40 ° C.
1. varme absorberet af metal:
* Q =50 g * C * (40 ° C - 20 ° C) =1000C J
2. varme frigivet af vand:
* Q =100 g * 4,18 J/g ° C * (80 ° C - 60 ° C) =8360 J
3.
* 1000c J =8360 J
4. Løsning for specifik varme:
* C =8360 J / 1000 G =8,36 J / G ° C
Derfor er den specifikke varme i metalprøven 8,36 J/g ° C.
Vigtige noter:
* Kalorimetri er en forenklet model, og målinger i den virkelige verden kan påvirkes af faktorer som varmetab til omgivelserne.
* Det er vigtigt at sikre, at kalorimeteret er godt isoleret for at minimere varmetab.
* Den specifikke varme af et stof kan variere lidt afhængigt af dets fase (faste, flydende, gas) og temperatur.
 Varme artikler
Varme artikler
-
 Måling af COVID-tests følsomhed med nyt materiale fra NISTNIST-materialet indeholder de to RNA-fragmenter vist her. Hvert af disse to fragmenter er omtrent 4, 000 bogstaver langt. NIST-forskere valgte at syntetisere disse særlige fragmenter, fordi de indehol
Måling af COVID-tests følsomhed med nyt materiale fra NISTNIST-materialet indeholder de to RNA-fragmenter vist her. Hvert af disse to fragmenter er omtrent 4, 000 bogstaver langt. NIST-forskere valgte at syntetisere disse særlige fragmenter, fordi de indehol -
 Ignorerende store tavse gener lader bakterier producere nye molekyler, potentielle lægemiddelkandid…Illinois -forskere udviklede en teknik til at deaktivere tavse gener i Streptomyces -bakterier ved hjælp af lokke -DNA -fragmenter for at lokke repressorer væk. På billedet, fra venstre:postdoktor Fan
Ignorerende store tavse gener lader bakterier producere nye molekyler, potentielle lægemiddelkandid…Illinois -forskere udviklede en teknik til at deaktivere tavse gener i Streptomyces -bakterier ved hjælp af lokke -DNA -fragmenter for at lokke repressorer væk. På billedet, fra venstre:postdoktor Fan -
 Lys i mørket:Ny opdagelse gør mikroskopisk billeddannelse mulig under mørke forholdStyring af kemiluminescens i to dimensioner. Kredit:Dr Yan Vogel, Curtin Universitet Curtin University-forskere har opdaget en ny måde at analysere mikroskopiske prøver mere nøjagtigt på ved i det
Lys i mørket:Ny opdagelse gør mikroskopisk billeddannelse mulig under mørke forholdStyring af kemiluminescens i to dimensioner. Kredit:Dr Yan Vogel, Curtin Universitet Curtin University-forskere har opdaget en ny måde at analysere mikroskopiske prøver mere nøjagtigt på ved i det -
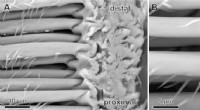 Overraskende opdagelse af edderkoppehår kan inspirere til stærkere klæbemidlerScanning Electron Microscopy (SEM) billede af baserne af pretarsal (dvs. på nederste del af benet) klæbende hår. (A) Til venstre er hårskaftene på de klæbende hår nærmest exoskeleton. Ved deres indsæt
Overraskende opdagelse af edderkoppehår kan inspirere til stærkere klæbemidlerScanning Electron Microscopy (SEM) billede af baserne af pretarsal (dvs. på nederste del af benet) klæbende hår. (A) Til venstre er hårskaftene på de klæbende hår nærmest exoskeleton. Ved deres indsæt
- Hvilken ydre planet har ringe?
- Kontrast af hvilken plante- og dyrecelle har?
- Folk genbruger mere, når de ved, hvad genanvendeligt affald bliver til
- Produktion af brint fra havvand
- Undersøgelse analyserer, hvordan faktatjekkere fra fire forskellige lande vurderer påstande om kli…
- Tandløse dinos tabte cifre peger på spredning af papegøje-lignende arter


