Hvad skal et ikke-metalatom som jod gøre for at blive stabilt?
* octet regel: Atomer stræber efter at have en fuld ydre skal af elektroner, som normalt indeholder 8 elektroner ("Octet -reglen"). Denne konfiguration giver stabilitet.
* jodens elektronkonfiguration: Jod har 7 elektroner i sin yderste skal.
* At få en elektron: Ved at få en elektron afslutter jod sin ydre skal og når en stabil konfiguration med 8 elektroner. Dette gør det til en anion med en -1 -opladning (i⁻).
Vigtig note: Ikke-metaller får generelt elektroner til at blive stabile og danner negativt ladede ioner (anioner). Dette er i modsætning til metaller, der har en tendens til at miste elektroner for at blive positivt ladede ioner (kationer).
Sidste artikelHvad er affarvningsmidlet i syre hurtig plet?
Næste artikelHvilket stof er C55H68O5N4MG?
 Varme artikler
Varme artikler
-
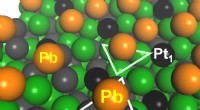 Ultrastabil, udviklet selektiv katalysator til propandehydrogeneringPå overfladen af den nyudviklede katalysator (PtGa-Pb/SiO2), Pt1-steder forbliver eksponerede for at lette katalytisk reaktion, mens Pt3-steder (og Ga3-steder) vist med trekanter blokeres af Pb. Kre
Ultrastabil, udviklet selektiv katalysator til propandehydrogeneringPå overfladen af den nyudviklede katalysator (PtGa-Pb/SiO2), Pt1-steder forbliver eksponerede for at lette katalytisk reaktion, mens Pt3-steder (og Ga3-steder) vist med trekanter blokeres af Pb. Kre -
 Nyt retroreflekterende materiale kunne bruges i natlige farveskiftende vejskilteEn billedserie viser, hvordan et nyt retroreflekterende materiale kan bruges til at lave et farveskiftende fartgrænseskilt. Bokserne A-F viser, hvordan skiltet skifter farve, fra bilisters perspektiv
Nyt retroreflekterende materiale kunne bruges i natlige farveskiftende vejskilteEn billedserie viser, hvordan et nyt retroreflekterende materiale kan bruges til at lave et farveskiftende fartgrænseskilt. Bokserne A-F viser, hvordan skiltet skifter farve, fra bilisters perspektiv -
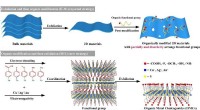 2-D-bestilte organiske metalchalcogenider udviklet med vidt indstillelige elektroniske båndgabSkematisk illustration af forskningen. Kredit:Prof. XUs gruppe To-dimensionelle (2-D) materialer, som viser fremragende fysiske og kemiske egenskaber, har modtaget hidtil uset opmærksomhed og er b
2-D-bestilte organiske metalchalcogenider udviklet med vidt indstillelige elektroniske båndgabSkematisk illustration af forskningen. Kredit:Prof. XUs gruppe To-dimensionelle (2-D) materialer, som viser fremragende fysiske og kemiske egenskaber, har modtaget hidtil uset opmærksomhed og er b -
 Hurtig flydende emballage:Omsluttende vandsilhuetter i 3-D-polymermembraner til eksperimenter med la…Vandemballage af en siddende dråbe. Kredit:Science Advances, doi:10.1126/sciadv.aat5189 Evnen til at indeslutte vand i et lukket rum uden direkte at manipulere det eller bruge stive beholdere er e
Hurtig flydende emballage:Omsluttende vandsilhuetter i 3-D-polymermembraner til eksperimenter med la…Vandemballage af en siddende dråbe. Kredit:Science Advances, doi:10.1126/sciadv.aat5189 Evnen til at indeslutte vand i et lukket rum uden direkte at manipulere det eller bruge stive beholdere er e
- Hvor mange stjerner er der på himlen?
- Hvor meget altseende AI-overvågning er for meget?
- Ukontrollerede klimaændringer vil forårsage alvorlig udtørring af Amazonas-skoven
- Et strejf af guld og sølv
- Overholder elektrostatisk kraft Newton tredje bevægelseslov?
- Bladsensorer kan fortælle landmændene, hvornår afgrøder skal vandes


