Hvad er volumen O2 -gas i nedbrydningen 5,0 g Hgo ved 550 grader Celsius A -tryk 3 ATM?
1. Afbalanceret kemisk ligning:
Nedbrydningen af kviksølv (II) oxid (HGO) er repræsenteret af følgende ligning:
2 HGO (S) → 2 Hg (L) + O₂ (G)
2. Mol af HGO:
* Find den molære masse af HGO:
* Hg:200,59 g/mol
* O:16,00 g/mol
* Molmasse HGO =200,59 + 16,00 =216,59 g/mol
* Beregn mol af HGO:
* mol =masse / molær masse
* mol =5,0 g / 216,59 g / mol =0,0231 mol HGO
3. Mol O₂:
* Brug molforholdet fra den afbalancerede ligning:2 mol HGO producerer 1 mol O₂
* mol O₂ =(0,0231 mol Hgo) * (1 mol O₂ / 2 mol Hgo) =0,0116 mol O₂
4. Ideel gaslov:
* Vi bruger den ideelle gaslov til at finde mængden af O₂:
* PV =NRT
* Hvor:
* P =pres (i atm) =3 atm
* V =volumen (i liter)
* n =mol gas =0,0116 mol
* R =ideel gas konstant =0,0821 l · atm/(mol · k)
* T =temperatur (i Kelvin) =550 ° C + 273,15 =823,15 K
5. Løs for volumen:
* V =(NRT) / P
* V =(0,0116 mol * 0,0821 L · atm / (mol · k) * 823,15 K) / 3 atm
* V ≈ 0,26 L
Derfor er mængden af O₂ -gas produceret fra nedbrydningen af 5,0 g HgO ved 550 ° C og 3 atm ca. 0,26 liter.
Sidste artikelHvad gør et stof magnetisk?
Næste artikelHvor mange komponenter er der i salt og vand, når de kombineres?
 Varme artikler
Varme artikler
-
 Bioinspirerede materialer—Graphen-aktiverede nikkelkompositterNi/grafen pulvere efter forskydningsblanding og frysetørring. (A) SEM billede af Ni/grafen pulvere, viser ingen mærkbar aggregering af grafenark. (B) TEM billede af overfladen af et Ni/grafen pulver
Bioinspirerede materialer—Graphen-aktiverede nikkelkompositterNi/grafen pulvere efter forskydningsblanding og frysetørring. (A) SEM billede af Ni/grafen pulvere, viser ingen mærkbar aggregering af grafenark. (B) TEM billede af overfladen af et Ni/grafen pulver -
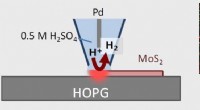 Billedbehandlingsteknik giver katalytisk 2-D materialeteknik et bedre udsynScanning elektrokemisk cellemikroskopi (SECCM) muliggør billeddannelse og kvantitativ analyse af hydrogenudviklingsreaktion (HER) katalytisk aktive steder i 1H MoS 2 monolag. Kredit:Kanazawa Univers
Billedbehandlingsteknik giver katalytisk 2-D materialeteknik et bedre udsynScanning elektrokemisk cellemikroskopi (SECCM) muliggør billeddannelse og kvantitativ analyse af hydrogenudviklingsreaktion (HER) katalytisk aktive steder i 1H MoS 2 monolag. Kredit:Kanazawa Univers -
 Fysikstuderende udvikler maskinlæringsmodel til energi- og miljøapplikationerEn fysikstuderende ved West Virginia University har skabt en ny maskinlæringsmodel, der har potentialet til at gøre søgningen efter energi- og miljømaterialer mere effektiv. Gihan Panapitiya, en dokt
Fysikstuderende udvikler maskinlæringsmodel til energi- og miljøapplikationerEn fysikstuderende ved West Virginia University har skabt en ny maskinlæringsmodel, der har potentialet til at gøre søgningen efter energi- og miljømaterialer mere effektiv. Gihan Panapitiya, en dokt -
 De miljømæssige omkostninger ved kontaktlinserKontaktlinser genvundet fra behandlet spildevandsslam kan skade miljøet. Kredit:Charles Rolsky Mange mennesker er afhængige af kontaktlinser for at forbedre deres syn. Men disse synskorrigerende e
De miljømæssige omkostninger ved kontaktlinserKontaktlinser genvundet fra behandlet spildevandsslam kan skade miljøet. Kredit:Charles Rolsky Mange mennesker er afhængige af kontaktlinser for at forbedre deres syn. Men disse synskorrigerende e


