Forklar partikelarrangementet i faste stoffer væsker og gasser energi associeret med hver fase?
Partikelarrangement og energi i faste stoffer, væsker og gasser
De tilstande med stof (fast, flydende og gas) bestemmes af arrangementet og bevægelsen af deres bestanddele (atomer, molekyler eller ioner).
Her er en sammenbrud af deres egenskaber:
faste stoffer:
* Arrangement: Partikler er tæt pakket og arrangeret i et regelmæssigt, gentagende mønster kaldet et krystalgitter.
* Bevægelse: Partikler vibrerer i faste positioner inden for gitteret. De har lav kinetisk energi.
* Energi: Faststoffer har de laveste energiniveauer i de tre stater.
* Karakteristika: Faststoffer har en fast form og volumen. De er ukomprimerbare og stive.
væsker:
* Arrangement: Partikler er tæt på hinanden, men er ikke i et fast arrangement. De har en mere forstyrret struktur sammenlignet med faste stoffer.
* Bevægelse: Partikler kan bevæge sig forbi hinanden, men tiltrækkes stadig af hinanden. De har moderat kinetisk energi.
* Energi: Væsker har højere energiniveau end faste stoffer, men lavere end gasser.
* Karakteristika: Væsker har et fast volumen, men tag formen på deres beholder. De er relativt ukomprimerbare.
Gasser:
* Arrangement: Partikler er bredt fordelt og er i konstant, tilfældig bevægelse. De har ingen fast arrangement.
* Bevægelse: Partikler bevæger sig frit og uafhængigt og kolliderer med hinanden og væggene i deres beholder. De har den højeste kinetiske energi.
* Energi: Gasser har de højeste energiniveau i de tre stater.
* Karakteristika: Gasser har ingen fast form eller volumen. De er let komprimerbare og udvides for at fylde deres beholder.
Energi og faseovergange:
Energien forbundet med hver tilstand er direkte relateret til partiklernes kinetiske energi. Når et stof absorberer energi (varme), bevæger dets partikler sig hurtigere og øger deres kinetiske energi. Dette kan føre til en faseovergang:
* fast til væske (smeltning): Tilsætning af varme øger partiklernes kinetiske energi i et fast stof, hvilket får dem til at bryde fri fra det stive gitter og bevæge sig mere frit. Dette resulterer i en væske.
* væske til gas (kogning/fordampning): Yderligere opvarmning øger kinetisk energi, hvilket gør det muligt for partikler i en væske at overvinde de attraktive kræfter, der holder dem sammen og undslipper i den gasformige tilstand.
* gas til væske (kondens): Når gaspartikler mister energi, bremser de sig og bliver tættere sammen og danner til sidst en væske.
* væske til fast (frysning): Afkøling af en væske fjerner energi, hvilket får partikler til at bremse og danne en stiv gitterstruktur.
nøglepunkter at huske:
* Temperatur er et mål for den gennemsnitlige kinetiske energi af partikler.
* Jo højere energiniveauet er, jo mere har bevægelsespartikler.
* Faseovergange involverer ændringer i energiniveauet og arrangementet af partikler.
Ved at forstå forholdet mellem partikelarrangement, bevægelse og energi, kan vi bedre forstå egenskaberne og opførslen i forskellige materiens tilstande.
Sidste artikelNavn 3 metaller, der er blandinger?
Næste artikelHvad gør et stof magnetisk?
 Varme artikler
Varme artikler
-
 Forskere udvikler en ny metode til at overvåge molekylær aggregeringSimulerede kirotiske egenskaber kontra dihedral vinkel θ af (R)1, 1-binaphthyl. Kredit:Hong Kong University of Science and Technology Chirale molekyler er defineret som molekyler, der ikke kan ove
Forskere udvikler en ny metode til at overvåge molekylær aggregeringSimulerede kirotiske egenskaber kontra dihedral vinkel θ af (R)1, 1-binaphthyl. Kredit:Hong Kong University of Science and Technology Chirale molekyler er defineret som molekyler, der ikke kan ove -
 Humanemembranproteiner opnår evolutionær balanceFigur 1:Foldeprocessen af en glukosetransportør ved hjælp af magnetisk pincet. En høj kraft påføres først for at afvikle proteinet fuldstændigt. Den påførte kraft sænkes derefter, hvilket gør det mu
Humanemembranproteiner opnår evolutionær balanceFigur 1:Foldeprocessen af en glukosetransportør ved hjælp af magnetisk pincet. En høj kraft påføres først for at afvikle proteinet fuldstændigt. Den påførte kraft sænkes derefter, hvilket gør det mu -
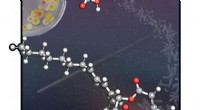 En molekylær trojansk hestDe wienske videnskabsmænd ledet af Maulide udviklede en metode, der anvender en 4-leddet ringprecursor til hurtigt at samle makrocyklussen af de naturlige produkter. Kredit:Giovanni Di Mauro/Maulide
En molekylær trojansk hestDe wienske videnskabsmænd ledet af Maulide udviklede en metode, der anvender en 4-leddet ringprecursor til hurtigt at samle makrocyklussen af de naturlige produkter. Kredit:Giovanni Di Mauro/Maulide -
 Biostasis har til formål at forhindre død efter traumatisk skade ved at bremse biokemiske reaktion…DARPAs Biostasis-program har til formål at forhindre død efter traumatisk skade ved at bremse biokemiske reaktioner inde i celler, dermed forlænge den gyldne time for medicinsk intervention. De ønsked
Biostasis har til formål at forhindre død efter traumatisk skade ved at bremse biokemiske reaktion…DARPAs Biostasis-program har til formål at forhindre død efter traumatisk skade ved at bremse biokemiske reaktioner inde i celler, dermed forlænge den gyldne time for medicinsk intervention. De ønsked
- Hvordan kæmper delfiner hajer?
- Hvem får mest ud af højtuddannede udenlandske arbejdere?
- Maskinens intelligens på ISS
- Hvad er den rigtige rækkefølge af kogepunkter fra højeste til laveste for et carbonhydrid, en alk…
- Hvordan ændres det, når man tilsætter sukker til vand?
- USA udsender hackingsikkerhedsalarm til små fly


