Hvad er binding ved elektronoverførsel?
Her er den grundlæggende idé:
* metaller har en tendens til at miste elektroner (bliver positivt ladede kationer).
* ikke -metaller har en tendens til at vinde elektroner (bliver negativt ladede anioner).
Når et metal og et ikke -metal samles, overfører metalatomet en eller flere elektroner til ikke -metalatomet. Dette skaber en elektrostatisk tiltrækning mellem de modsatte ladede ioner, der danner en ionisk binding .
Eksempel:
Overvej dannelsen af natriumchlorid (NaCl):
* natrium (NA) , et metal, mister et elektron for at blive et positivt ladet natriumion (Na⁺).
* klor (Cl) , en ikke -metal, får en elektron til at blive en negativt ladet chloridion (CL⁻).
Disse modsatte ladede ioner tiltrækkes af hinanden og danner en ionisk binding.
Nøglepunkter:
* Elektronoverførselsprocessen er forenklet. I virkeligheden overføres elektronerne ikke fuldstændigt, men deles snarere ulige.
* De resulterende ioner holdes sammen af elektrostatiske kræfter.
* Ioniske bindinger er typisk stærke og resulterer i dannelse af faste forbindelser med høje smeltepunkter.
Bemærk: Mens konceptet med elektronoverførsel er nyttigt til at forstå ionisk binding, er det vigtigt at huske, at bindingens sande natur er mere kompleks og involverer delte elektroner (kovalent binding).
 Varme artikler
Varme artikler
-
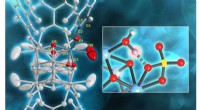 Forskere opdager, at hydrering er nøglen til at forbedre katalysatorydelsen til industriel brug(venstre) Neutroner afslørede, hvilket Brønsted-syrested i MOF-808-SO4, der primært er ansvarlig for MOFs evne til effektivt at omdanne basestoffer som råolie til andre kemikalier. (til højre) De afsl
Forskere opdager, at hydrering er nøglen til at forbedre katalysatorydelsen til industriel brug(venstre) Neutroner afslørede, hvilket Brønsted-syrested i MOF-808-SO4, der primært er ansvarlig for MOFs evne til effektivt at omdanne basestoffer som råolie til andre kemikalier. (til højre) De afsl -
 Undersøgelse afslører, hvordan bakterier kommunikerer i grupper for at undgå antibiotikaKredit:CC0 Public Domain I en ny undersøgelse offentliggjort i Journal of Biological Chemistry ( JBC ), forskere fra University of Notre Dame og University of Illinois i Urbana-Champaign har f
Undersøgelse afslører, hvordan bakterier kommunikerer i grupper for at undgå antibiotikaKredit:CC0 Public Domain I en ny undersøgelse offentliggjort i Journal of Biological Chemistry ( JBC ), forskere fra University of Notre Dame og University of Illinois i Urbana-Champaign har f -
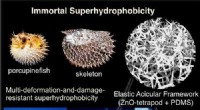 Porcupinefish inspirerer robust superhydrofobt materialeKredit:American Chemical Society Naturen har udviklet et blændende udvalg af materialer, der hjælper organismer med at trives i forskellige levesteder. Sommetider, videnskabsmænd kan udnytte disse
Porcupinefish inspirerer robust superhydrofobt materialeKredit:American Chemical Society Naturen har udviklet et blændende udvalg af materialer, der hjælper organismer med at trives i forskellige levesteder. Sommetider, videnskabsmænd kan udnytte disse -
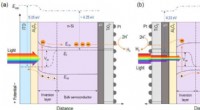 Rumlig afkobling af lysabsorption og reaktionssteder i n-Si fotokatoder til solvandssplitningSkematisk energibåndsdiagram over (a) belysningsreaktion afkoblet n-Si MIS fotokatode og (b) traditionel p-Si MIS fotokatode for HER under belysning. Kredit:Science China Press Solar-drevet fotoel
Rumlig afkobling af lysabsorption og reaktionssteder i n-Si fotokatoder til solvandssplitningSkematisk energibåndsdiagram over (a) belysningsreaktion afkoblet n-Si MIS fotokatode og (b) traditionel p-Si MIS fotokatode for HER under belysning. Kredit:Science China Press Solar-drevet fotoel
- NASAs Webb-teleskop vil studere Jupiter, dens ringe, og to spændende måner
- Stamcelleharmoni:Hvordan solanaceae-planter opretholder homeostase gennem receptorkompensation
- Den mindste stjerne, der nogensinde er observeret, er en del af et eksotisk binært system
- Selvkørende køretøjer i mikroskala
- Hvorfor månenfaser forekommer
- Hvilke organeller er membran Sacs brugt til transportmolekyler?


