Hvorfor ilt fra en hydroxylgruppe fungerer som nukleofil eller base?
1. Enlige par elektroner: Oxygenatomet i en hydroxylgruppe har to ensomme par elektroner. Disse ensomme par er let tilgængelige til at donere til elektronmangel art, hvilket gør ilt til en nukleofil .
2. Høj elektrondensitet: Oxygenatomet er meget elektronegativt, hvilket gør hydroxylgruppen elektronrig. Denne høje elektrondensitet gør iltatomet tiltrukket af elektronmangel centre, hvilket yderligere forbedrer dens nukleofile karakter.
3. Evne til abstrakte protoner: Oxygenatomet kan også abstrahere en proton fra en stærk syre, danne vand og en konjugat base. Denne evne til at acceptere protoner definerer hydroxylgruppens grundlæggende karakter .
nukleofile reaktioner:
I nukleofile reaktioner kan iltatomet i en hydroxylgruppe angribe elektrofiler som carbocations, carbonylgrupper eller alkylhalogenider, hvilket fører til dannelse af nye bindinger.
Eksempler:
* alkoholangreb på carbocations: Hydroxylgruppen af en alkohol kan angribe en carbocation, hvilket fører til dannelse af en ether.
* Hydrolyse af estere: Hydroxylgruppen vand kan angribe carbonylcarbonet i en ester, hvilket fører til dannelse af en carboxylsyre og en alkohol.
Grundlæggende reaktioner:
I basale reaktioner kan iltatomet i en hydroxylgruppe abstrahere en proton fra en stærk syre, hvilket fører til dannelse af vand og en konjugatbase.
Eksempler:
* reaktion med stærke syrer: Hydroxylgruppen af en alkohol kan reagere med stærke syrer som saltsyre (HCI), danner vand og en alkoxidion.
* deprotonering af svage syrer: Hydroxylgruppen af en base som natriumhydroxid (NaOH) kan afprotonere svage syrer som carboxylsyrer, danne vand og den tilsvarende carboxylatanion.
Kortfattet:
Oxygenatomet i en hydroxylgruppe udviser både nukleofil og grundlæggende karakter på grund af dets ensomme par elektroner, høj elektrondensitet og evne til at acceptere protoner. Denne dobbelte funktionalitet gør hydroxylgrupper alsidige reaktanter i en række kemiske reaktioner.
 Varme artikler
Varme artikler
-
 Hvordan selenforbindelser kan blive katalysatorerPatrick Wonner og Stefan Huber har overført princippet om hydrogenbindingen til andre grundstoffer. Kredit:RUB, Marquard Kemikere ved Ruhr-Universität Bochum har testet en ny tilgang til aktiverin
Hvordan selenforbindelser kan blive katalysatorerPatrick Wonner og Stefan Huber har overført princippet om hydrogenbindingen til andre grundstoffer. Kredit:RUB, Marquard Kemikere ved Ruhr-Universität Bochum har testet en ny tilgang til aktiverin -
 Dekontaminering af mandler og nødder med komprimeret kuldioxidBakteriekulturen udplades i et næringsmedium. Kredit:Karen Fuchs/Fraunhofer UMSICHT Der går næsten ikke en dag, uden at producenter husker mad, der er plettet af urenheder. Selv tørre fødevarer, g
Dekontaminering af mandler og nødder med komprimeret kuldioxidBakteriekulturen udplades i et næringsmedium. Kredit:Karen Fuchs/Fraunhofer UMSICHT Der går næsten ikke en dag, uden at producenter husker mad, der er plettet af urenheder. Selv tørre fødevarer, g -
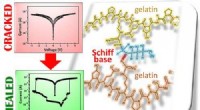 Selvreparerende gelatinebaseret film kan være et smart træk for elektronikKredit:American Chemical Society At tabe en mobiltelefon kan nogle gange forårsage overfladiske revner. Men andre gange, enheden kan helt stoppe med at fungere, fordi der udvikles brud i det mater
Selvreparerende gelatinebaseret film kan være et smart træk for elektronikKredit:American Chemical Society At tabe en mobiltelefon kan nogle gange forårsage overfladiske revner. Men andre gange, enheden kan helt stoppe med at fungere, fordi der udvikles brud i det mater -
 Forskere udvikler en katalysator til at lette selektiv omdannelse af reaktive lithiumforbindelserBochums forskningsteam har udviklet en ny katalysator, der kunne være interessant til industrielle anvendelser. Kredit:RUB, Marquard Forskere ved Ruhr-Universität Bochum har udviklet en ny katalys
Forskere udvikler en katalysator til at lette selektiv omdannelse af reaktive lithiumforbindelserBochums forskningsteam har udviklet en ny katalysator, der kunne være interessant til industrielle anvendelser. Kredit:RUB, Marquard Forskere ved Ruhr-Universität Bochum har udviklet en ny katalys
- Hvilke konstellationer er der ved siden af Orion?
- Radikal afsaltningstilgang kan forstyrre vandindustrien
- Det membranbundne enzymsystem, der gendanner og opretholder hvilemembranpotentialet, er hvilken pump…
- Dark Energy Camera fanger detaljeret billede af slående ejendommelige galakser
- Hvad er de geografiske træk Athen?
- En mammutopgave – hvordan beslutter vi, hvilken art der skal genopstå?


