Hvorfor er NBR3 et ikke-polært molekyle?
* molekylær geometri: NBR3 har en trigonal pyramidal form. Dette skyldes nitrogenatomet med tre bindingspar og et ensomt par elektroner.
* Elektronegativitetsforskel: Brom er mere elektronegativ end nitrogen. Dette betyder, at bromatomerne trækker de delte elektroner i N-BR-bindingerne tættere på sig selv, hvilket skaber delvis negative ladninger (Δ-) på bromatomerne og en delvis positiv ladning (Δ+) på nitrogenatomet.
* dipolmoment: De individuelle bindingsdipoler (fra de polære N-BR-bindinger) annullerer ikke hinanden på grund af molekylets asymmetriske form. De skaber et netto dipolmoment og peger mod bromatomerne.
Derfor har NBR3 et permanent dipolmoment , hvilket gør det til et polært molekyle .
 Varme artikler
Varme artikler
-
 En hydrogel, der klæber godt til brusk og meniskKredit:Ecole Polytechnique Federale de Lausanne EPFL-forskere har udviklet en hydrogel – bestående af næsten 90 % vand – som naturligt klæber til blødt væv som brusk og menisken. Hvis hydrogelen b
En hydrogel, der klæber godt til brusk og meniskKredit:Ecole Polytechnique Federale de Lausanne EPFL-forskere har udviklet en hydrogel – bestående af næsten 90 % vand – som naturligt klæber til blødt væv som brusk og menisken. Hvis hydrogelen b -
 Rødt lys til stress:En farveskiftende organisk krystalKredit:Institut for Industrividenskab, Universitetet i Tokyo Forskere ved Institut for Industrividenskab, del af University of Tokyo, og Yokohama City University har introduceret nye farveskiftend
Rødt lys til stress:En farveskiftende organisk krystalKredit:Institut for Industrividenskab, Universitetet i Tokyo Forskere ved Institut for Industrividenskab, del af University of Tokyo, og Yokohama City University har introduceret nye farveskiftend -
 Multimodal billeddannelse viser, at stamme kan drive kemi i et fotovoltaisk materialeI en tynd film af et solenergimateriale, molekyler i tvillingedomæner (modelleret i venstre og højre panel) justeres i modsatrettede orienteringer inden for korngrænser (vist ved scanning elektronmikr
Multimodal billeddannelse viser, at stamme kan drive kemi i et fotovoltaisk materialeI en tynd film af et solenergimateriale, molekyler i tvillingedomæner (modelleret i venstre og højre panel) justeres i modsatrettede orienteringer inden for korngrænser (vist ved scanning elektronmikr -
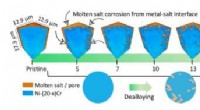 Forskere ser smeltede salte skære små kroge og tunneler ind i metallegeringer i 3DIllustrationen viser, hvordan smeltet salt over tid fjerner metallisk materiale (blå) fra prøven i 3D (øvre) og 2D -visualiseringer (nedre). Denne proces, såkaldt dealloying skaber et bikontinuerligt
Forskere ser smeltede salte skære små kroge og tunneler ind i metallegeringer i 3DIllustrationen viser, hvordan smeltet salt over tid fjerner metallisk materiale (blå) fra prøven i 3D (øvre) og 2D -visualiseringer (nedre). Denne proces, såkaldt dealloying skaber et bikontinuerligt
- Hvilken type solarrangementer er der?
- En anden skole har forbudt mobiltelefoner, men forskning viser, at forbud ikke stopper mobning eller…
- I hvilken retning står du over for, når du ser på konstellationen Leo?
- 11 eksperttip til bedre søgning på Google, hurtigere, mere strategisk
- Hvad sker der, når lever og mangandioxid koges?
- Frisk regn støder på Brasiliens oversvømmelsesramte sydpå, da evakueringerne fordobles


