Hvornår finder en kemisk reaktion sted?
1. Reaktanter kolliderer med tilstrækkelig energi:
* Molekyler skal have nok kinetisk energi til at overvinde aktiveringsenergibarrieren, hvilket er den minimale energi, der kræves for at reaktionen kan forekomme.
* Denne energi kan komme fra varme, lys eller andre former for energi.
2. Reaktanter kolliderer med den korrekte orientering:
* Molekyler skal kollidere på en måde, der gør det muligt for atomerne at interagere og omarrangere.
* Dette betyder, at de reaktive dele af molekylerne skal vende mod hinanden.
3. Reaktionen er termodynamisk gunstig:
* Produkterne fra reaktionen skal være mere stabile end reaktanterne, hvilket betyder, at reaktionen frigiver energi (eksoterme) eller kræver mindre energi for at opretholde (endoterm).
Kortfattet:
En kemisk reaktion opstår, når reaktanter kolliderer med nok energi og i den korrekte orientering, og reaktionen er termodynamisk gunstig. Dette resulterer i dannelsen af nye kemiske bindinger og brud på gamle, hvilket fører til dannelse af produkter med forskellige kemiske egenskaber end reaktanterne.
 Varme artikler
Varme artikler
-
 Forskere udvikler wolfram-baserede brintdetektorerMorfologien af Pt/WOx/SiC-strukturen. Kredit:V.V. Zuyev et al./et brev til Journal of Technical Physics, 2015 Et hold fysikere fra Immanuel Kant Baltic Federal University har sammen med deres ko
Forskere udvikler wolfram-baserede brintdetektorerMorfologien af Pt/WOx/SiC-strukturen. Kredit:V.V. Zuyev et al./et brev til Journal of Technical Physics, 2015 Et hold fysikere fra Immanuel Kant Baltic Federal University har sammen med deres ko -
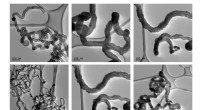 Fra genbrug til upcycling:En smartere måde at håndtere plast påEksempler på carbon nanorør produceret med den nye tilgang, ved forskellige forstørrelser. Kredit:RMIT University Globalt genbruges kun omkring 20% af affaldsplast. At øge dette tal er stadig en
Fra genbrug til upcycling:En smartere måde at håndtere plast påEksempler på carbon nanorør produceret med den nye tilgang, ved forskellige forstørrelser. Kredit:RMIT University Globalt genbruges kun omkring 20% af affaldsplast. At øge dette tal er stadig en -
 Hvordan vitaminer, steroider og potentielle antivirale midler kan påvirke SARS-CoV-2Kredit:Pixabay/CC0 Public Domain Der er vidnesbyrd om, at D-vitamin – og muligvis K- og A-vitamin – kan hjælpe med at bekæmpe COVID-19. En ny undersøgelse fra University of Bristol offentliggjort
Hvordan vitaminer, steroider og potentielle antivirale midler kan påvirke SARS-CoV-2Kredit:Pixabay/CC0 Public Domain Der er vidnesbyrd om, at D-vitamin – og muligvis K- og A-vitamin – kan hjælpe med at bekæmpe COVID-19. En ny undersøgelse fra University of Bristol offentliggjort -
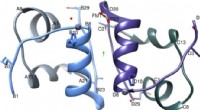 Ny forskning kan føre til flere behandlingsmuligheder for diabetespatienterIGlu-dimer med den to-foldede akse (grøn pil), A-kæden er farvet lysegrå, B-kæde i lyseblå, C-kæde i mørkegrå og D-kæde i lilla. Figur oprettet ved hjælp af Chimera v1.8.1 cgl.ucsf.edu/chimera/. Kredi
Ny forskning kan føre til flere behandlingsmuligheder for diabetespatienterIGlu-dimer med den to-foldede akse (grøn pil), A-kæden er farvet lysegrå, B-kæde i lyseblå, C-kæde i mørkegrå og D-kæde i lilla. Figur oprettet ved hjælp af Chimera v1.8.1 cgl.ucsf.edu/chimera/. Kredi
- Hvilken SI-enhed til energi kaldes også Newton-meteren?
- Kan du tale? Apple-patent kræver iPhone-statuskontrolsystem
- Hvad er en diskere variabel?
- Forskere afslører rollen af naboadsorbater og kvantetunnelering i overfladediffusion af brintatom…
- Hvordan bruger du livsvidenskab i en sætning?
- Team opnår 30 gange forbedring af termoelektrisk ydeevne i polykrystallinsk tinselenid


