Ny forskning kan føre til flere behandlingsmuligheder for diabetespatienter
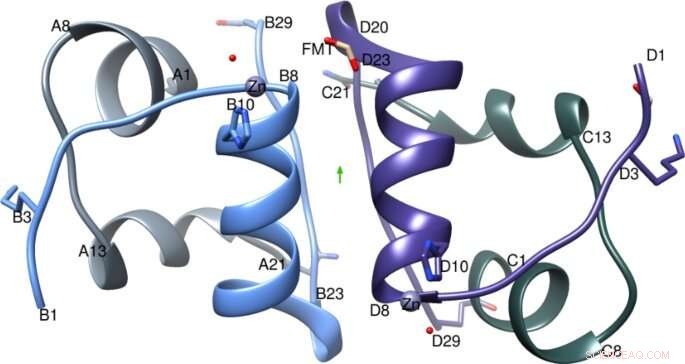
IGlu-dimer med den to-foldede akse (grøn pil), A-kæden er farvet lysegrå, B-kæde i lyseblå, C-kæde i mørkegrå og D-kæde i lilla. Figur oprettet ved hjælp af Chimera v1.8.1 cgl.ucsf.edu/chimera/. Kredit: Videnskabelige rapporter (2021). DOI:10.1038/s41598-021-81251-2
For første gang, Forskere er kommet med en præcis forklaring på atomniveau på, hvorfor glulisin - en almindeligt anvendt medicin til behandling af diabetes - virker hurtigere end insulin.
Fundene, udgivet i dag i Videnskabelige rapporter , kunne have fordele for diabetespatienter ved at sikre, at et mere forbedret insulin kan udvikles til fremtidig behandling.
Undersøgelsen blev udført af eksperter fra universiteterne i Nottingham og Manchester og Imperial College London, sammen med Diamond Light Source - Storbritanniens nationale synkrotronvidenskabsfacilitet.
Glulisine er et syntetisk hurtigtvirkende syntetisk insulin udviklet af Sanofi-Aventis-med et handelsnavn Apidra. Det bruges til at forbedre blodsukkerkontrollen hos voksne og børn med diabetes.
I denne nye undersøgelse, forskere satte sig for at fastslå den nøjagtige struktur af gluisin, og hvordan denne struktur kan påvirke den måde, hvorpå den opfører sig fysiologisk.
Teamet havde til formål at etablere, ved at undersøge strukturen, hvilken grundlæggende rolle gluisin spiller i diabetesbehandling. Disse fund kan potentielt føre til et forbedret syntetisk insulin for patienter, med færre bivirkninger.
Dr. Gary Adams lektor og læser i anvendt diabetessundhed ved University of Nottingham, og hovedforfatter af undersøgelsen, sagde:"For første gang, vores forskning giver nye, strukturel information om en klinisk relevant syntetisk insulin, glulisin, som er en vigtig behandling for de patienter med diabetes.
"Denne information kaster lys over dissociationen af glulisin og kan forklare dens hurtige dissociation til dimerer og monomerer og derved dens funktion som et hurtigtvirkende insulin. Denne nye information kan føre til en bedre forståelse af den farmakokinetiske og farmakodynamiske adfærd af glulisin og, på tur, kan hjælpe med at forbedre dets formulering og reducere bivirkninger af dette lægemiddel."
For at udføre undersøgelsen, holdet skabte en perfekt krystal af glulisin. Forskerne anvendte derefter en kombination af metoder til at give et detaljeret indblik i glulisins struktur og funktion.
Dr. Hodaya Solomon, et medlem af Imperial College-teamet, og fælles første forfatter sagde:"De vigtigste molekylære sammenligninger mellem denne krystalstruktur af glulisin og tidligere insulinkrystalstrukturer viste, at en unik position af glutaminsyren (en aminosyre), ikke til stede i andre hurtigtvirkende analoger, pegede indad i stedet for til ydersiden. Dette reducerer interaktioner med tilstødende molekyler og øger derfor præferencen for den mere aktive for patienter dimerform, give eksperterne en bedre forståelse af glulisins adfærd. "
John Helliwell, Emeritus professor i kemi ved University of Manchester, og en af avisens forfattere, sagde:"Et uventet fund var, at glulisinformuleringen er dokumenteret som en zinkfri insulinanalog for sin hurtige absorption. Insulinkrystallografi har vist, at zink er afgørende for dannelse af hexamer. Den nye glulisinkrystalstruktur viste zinkbundet på samme måde som i naturligt insulin, af tre histidinaminosyrer. Dette fund må betyde, at der er spor af zinkioner i den kommercielle, som leveret, formuleringsløsning. En yderligere optimering for glulisin er nu klar, det med endelig at fjerne zinken."
 Varme artikler
Varme artikler
-
 Verdens ældste ost fundet i egyptisk gravKredit:American Chemical Society Lagring forbedrer normalt smagen af ost, men det er ikke derfor, at en meget gammel ost, der blev opdaget i en egyptisk grav, gør opmærksom. I stedet, det menes
Verdens ældste ost fundet i egyptisk gravKredit:American Chemical Society Lagring forbedrer normalt smagen af ost, men det er ikke derfor, at en meget gammel ost, der blev opdaget i en egyptisk grav, gør opmærksom. I stedet, det menes -
 Brug af aluminium og vand til at lave rent brintbrændstofLaureen Meroueh PhD ’20 (billedet) og professorerne Douglas P. Hart og Thomas W. Eagar har vist, hvordan man bruger skrotaluminium plus vand til at generere den strøm af brint, der er nødvendig til en
Brug af aluminium og vand til at lave rent brintbrændstofLaureen Meroueh PhD ’20 (billedet) og professorerne Douglas P. Hart og Thomas W. Eagar har vist, hvordan man bruger skrotaluminium plus vand til at generere den strøm af brint, der er nødvendig til en -
 Forskere bruger 3D-tryk til at skabe metalliske glaslegeringer i løs vægtCylinderen vist her er en amorf jernlegering, eller metallisk glas, lavet ved hjælp af en additiv fremstillingsteknik. Kredit:Zaynab Mahbooba Forskere har nu demonstreret evnen til at skabe amorft
Forskere bruger 3D-tryk til at skabe metalliske glaslegeringer i løs vægtCylinderen vist her er en amorf jernlegering, eller metallisk glas, lavet ved hjælp af en additiv fremstillingsteknik. Kredit:Zaynab Mahbooba Forskere har nu demonstreret evnen til at skabe amorft -
 Nyt materiale kan frigøre potentialet for brintdrevne køretøjerKredit: Energi- og miljøvidenskab (2018). DOI:10.1039/C8EE02499E Forskere har opdaget et nyt materiale, der kunne holde nøglen til at frigøre potentialet i brintdrevne køretøjer. Mens verden ser
Nyt materiale kan frigøre potentialet for brintdrevne køretøjerKredit: Energi- og miljøvidenskab (2018). DOI:10.1039/C8EE02499E Forskere har opdaget et nyt materiale, der kunne holde nøglen til at frigøre potentialet i brintdrevne køretøjer. Mens verden ser
- Fysikere bekræfter observationelt Hawkings sorte hul-sætning for første gang
- Ikke-skole-bevægelsen, der hjælper unge mennesker med at engagere sig i læring igen
- Jupiters X-ray auroras pulserer uafhængigt
- Den første af sin slags amerikanske losseplads for atomaffald fylder 20 år
- Carbon Cycling in Aquatic Ecosystems
- Det mindste farvebillede, der nogensinde er trykt


