Hvordan er faste og gasvæske det samme?
* De er alle sammensat af atomer og molekyler. Forskellen ligger i, hvordan disse partikler er arrangeret og interagerer.
* de har alle masse og tager plads. Selvom gasser kan virke usynlige, har de stadig masse og besættelsesvolumen.
* de kan alle omdannes til andre tilstande af stof. Ved at ændre temperatur og tryk kan du skifte mellem faste, væske- og gastilstande. For eksempel kan der eksistere vand som is (fast), vand (væske) og damp (gas).
Her er en tabel, der opsummerer de vigtigste forskelle mellem faste stoffer, væsker og gasser:
| Funktion | Solid | Væske | Gas |
| --- | --- | --- | --- |
| form | Bestemt | Tager formen på sin beholder | Tager formen på sin beholder |
| volumen | Bestemt | Bestemt | Tager volumen på sin beholder |
| densitet | Høj | Høj | Lav |
| Kompressibilitet | Meget lav | Lav | Høj |
| Partikelarrangement | Rettet, tæt pakket | Tæt sammen, men kan bevæge sig rundt | Langt fra hinanden, bevæger sig tilfældigt |
| Partikelinteraktion | Stærk | Moderat | Svag |
Derfor, selvom faste stoffer, væsker og gasser har forskellige egenskaber, deler de grundlæggende egenskaber, da de alle er former for stof, der består af atomer og molekyler.
Sidste artikelHvad er den enkleste del af en forbindelse?
Næste artikelHvordan opløser du et solidt i solidt?
 Varme artikler
Varme artikler
-
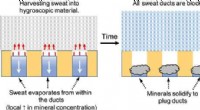 Vende sveden mod sig selv med en metalfri antiperspirantKredit:American Chemical Society Kropslugt er en ubehagelig lugt, produceres, når bakterier, der lever på huden, nedbryder proteinerne i sved. For at undgå at stinke, nogle mennesker anvender anti
Vende sveden mod sig selv med en metalfri antiperspirantKredit:American Chemical Society Kropslugt er en ubehagelig lugt, produceres, når bakterier, der lever på huden, nedbryder proteinerne i sved. For at undgå at stinke, nogle mennesker anvender anti -
 Video:Sushis sublime hemmelighederKredit:The American Chemical Society Sushi er sublimt. Bare frisk fisk og krydret ris i sin enkleste form serveret oven på hinanden, eller rullet sammen med nogle grøntsager i en tangindpakning. H
Video:Sushis sublime hemmelighederKredit:The American Chemical Society Sushi er sublimt. Bare frisk fisk og krydret ris i sin enkleste form serveret oven på hinanden, eller rullet sammen med nogle grøntsager i en tangindpakning. H -
 Forskere opdager metode til at kontrollere kræftfremkaldende formaldehydfrigivelse fra træ i hjemm…Kredit:Unsplash/CC0 Public Domain Ny forskning, ledet i fællesskab af University of Massachusetts Amherst og University of North Texas, fremmer vores forståelse af, hvordan træet i vores hjem og ko
Forskere opdager metode til at kontrollere kræftfremkaldende formaldehydfrigivelse fra træ i hjemm…Kredit:Unsplash/CC0 Public Domain Ny forskning, ledet i fællesskab af University of Massachusetts Amherst og University of North Texas, fremmer vores forståelse af, hvordan træet i vores hjem og ko -
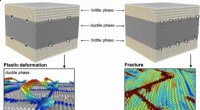 Foreslået ingeniørmetode kunne bidrage til at gøre bygninger og broer sikrereGrænseflade-dislokationskontrolleret deformation og fraktur i nanolagskompositter. Afstanden mellem grænsefladeforskydninger, som optager misfit-belastning mellem ferrit- og cementitfasen, bestemmer f
Foreslået ingeniørmetode kunne bidrage til at gøre bygninger og broer sikrereGrænseflade-dislokationskontrolleret deformation og fraktur i nanolagskompositter. Afstanden mellem grænsefladeforskydninger, som optager misfit-belastning mellem ferrit- og cementitfasen, bestemmer f
- World Water Day 2020:Afsaltningsteknologier giver sikkert og bæredygtigt drikkevand
- Anden lov om bevægelseseksperimenter
- En spand vand kan afsløre klimaændringernes indvirkning på livet i havet i Arktis
- I videnskaben, spørgsmål betyder meget. Mænd er mere tilbøjelige end kvinder til at spørge dem
- Hvad er dekomponetter af den videnskabelige undersøgelse?
- Undersøgelse advarer om, at fattigdommen stiger til over 1 milliard på grund af virus


