Hvorfor har nitrogen et ensomt par elektroner?
* nitrogens elektroniske konfiguration: Nitrogen har 7 elektroner med konfigurationen 1S² 2s² 2p³. Dette betyder, at det har 5 valenselektroner i sin yderste skal (2S² 2p³).
* octet regel: Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration med 8 elektroner i deres yderste skal (oktetreglen).
* nitrogens binding: Nitrogen danner tre kovalente bindinger ved at dele sine tre 2p -elektroner. Hver binding bruger en elektron fra nitrogen og et fra et andet atom.
* det ensomme par: Da nitrogen har 5 valenselektroner og kun bruger 3 til binding, har det 2 elektroner tilbage. Disse to elektroner danner et ensomt par, der ligger i en af 2p -orbitaler.
Tænk på det på denne måde:
* Nitrogen ønsker at være lykkelig, og at have 8 elektroner i sin ydre skal er dets lykkelige sted.
* Det danner tre obligationer for at få tre af disse elektroner.
* Det har stadig brug for to mere, så det holder disse to elektroner i nærheden som et ensomt par.
Dette ensomme par er vigtigt, fordi det påvirker nitrogens reaktivitet og evne til at deltage i forskellige reaktioner.
 Varme artikler
Varme artikler
-
 Filter kan være et match til fracking af vandEt superhydrofilt filter produceret på Rice University kan fjerne mere end 90 procent af forurenende stoffer fra vand, der bruges i hydrauliske fraktureringsoperationer. På dette billede, produceret v
Filter kan være et match til fracking af vandEt superhydrofilt filter produceret på Rice University kan fjerne mere end 90 procent af forurenende stoffer fra vand, der bruges i hydrauliske fraktureringsoperationer. På dette billede, produceret v -
 Undersøgelse afslører ny indsigt i, hvordan hybride perovskit-solceller fungererDenne illustration viser, hvad der sker inde i et hybridt perovskitmateriale i de første par billiontedele af et sekund, efter at det er ramt af simuleret sollys (øverst til venstre). De blå og grønne
Undersøgelse afslører ny indsigt i, hvordan hybride perovskit-solceller fungererDenne illustration viser, hvad der sker inde i et hybridt perovskitmateriale i de første par billiontedele af et sekund, efter at det er ramt af simuleret sollys (øverst til venstre). De blå og grønne -
 SwRI-udviklet mobilsystem til at ødelægge farlige kemiske krigsførende stoffer på stedetSwRI er ved at udvikle en mobil behandlingsenhed (til venstre) til at ødelægge kemiske midler. Efter at agenterne er blevet ødelagt, Udstødningsgasser ledes gennem et jordbaseret fluid bed og scrubber
SwRI-udviklet mobilsystem til at ødelægge farlige kemiske krigsførende stoffer på stedetSwRI er ved at udvikle en mobil behandlingsenhed (til venstre) til at ødelægge kemiske midler. Efter at agenterne er blevet ødelagt, Udstødningsgasser ledes gennem et jordbaseret fluid bed og scrubber -
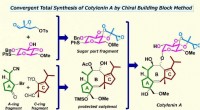 Total syntese af cotylenin A til et nyt kræftlægemiddel uden bivirkningerKredit:Nakada Laboratory, Waseda Universitet Det lykkedes for forskere ved Waseda University at udvikle en metode til en total syntese af cotylenin A, en plantevækstregulator, som har tiltrukket s
Total syntese af cotylenin A til et nyt kræftlægemiddel uden bivirkningerKredit:Nakada Laboratory, Waseda Universitet Det lykkedes for forskere ved Waseda University at udvikle en metode til en total syntese af cotylenin A, en plantevækstregulator, som har tiltrukket s
- Rekonstruktioner viser, hvordan nogle af de tidligste dyr levede - og døde (m/ video)
- Hvordan økonomisk teori og Netflix-prisen kunne gøre forskningsfinansiering mere effektiv
- Vulcans død:Undersøgelse afslører, at planeten faktisk er en astronomisk illusion forårsaget af …
- Hvad er ansvarlig for understøttende struktur og bevægelse i celler?
- Var en 'løvindernes elskerinde' konge i det gamle Kanaan?
- Vold i hjemmet rammer i uforholdsmæssig grad gengifte kvinder


