Binær ionisk forbindelse, hvor anionen og kationen hver har 10 elektroner?
forståelse af konceptet
* binære ioniske forbindelser: Disse forbindelser består af en metalkation (positivt ladet ion) og en ikke -metal anion (negativt ladet ion).
* 10 elektroner: Atomer med 10 elektroner er isoelektroniske med den ædle gas neon (NE). Dette betyder, at de har den samme elektronkonfiguration som neon.
Find elementerne
1. kation: For at have 10 elektroner skal kationen have mistet elektroner. Dette betyder, at det skal være et metal, der oprindeligt havde mere end 10 elektroner. Se efter elementer i gruppe 1, 2 eller 3 på den periodiske tabel.
* natrium (NA): Natrium har 11 elektroner og mister en til at blive Na+ med 10 elektroner.
* magnesium (mg): Magnesium har 12 elektroner og mister to for at blive Mg2+ med 10 elektroner.
* aluminium (AL): Aluminium har 13 elektroner og mister tre til at blive Al3+ med 10 elektroner.
2. anion: For at have 10 elektroner skal anionen have fået elektroner. Dette betyder, at det skal være en ikke -metal, der oprindeligt havde færre end 10 elektroner. Se efter elementer i grupper 16 eller 17 på den periodiske tabel.
* ilt (O): Oxygen har 8 elektroner og får to til at blive O2- med 10 elektroner.
* fluor (F): Fluor har 9 elektroner og får en til at blive F- med 10 elektroner.
mulige forbindelser
Baseret på ovenstående kan vi danne flere mulige binære ioniske forbindelser:
* na2o (Natriumoxid)
* mgo (Magnesiumoxid)
* al2o3 (Aluminiumoxid)
* naf (Natriumfluorid)
* mgf2 (Magnesiumfluorid)
* alf3 (Aluminiumfluorid)
Bemærk: Der kan være andre muligheder, hvis vi overvejer mindre almindelige ioner, men dette er de mest sandsynlige scenarier.
Sidste artikelHvilke metaller reagerer med syre for at producere brint?
Næste artikelHvad er ilt til brintmasseforhold H2O2?
 Varme artikler
Varme artikler
-
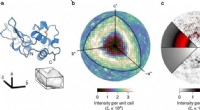 Forskere kortlægger proteinbevægelseret bånddiagram over lysozym (øverst) og den trikliniske enhedscelle, der indeholder et protein (nederst). b Der blev opnået et meget detaljeret tredimensionelt kort over diffus spredning. Den ydre kug
Forskere kortlægger proteinbevægelseret bånddiagram over lysozym (øverst) og den trikliniske enhedscelle, der indeholder et protein (nederst). b Der blev opnået et meget detaljeret tredimensionelt kort over diffus spredning. Den ydre kug -
 Genbrug af drivhusgasser:Nanopartikler på perovskitkrystaller undgår kokseffektFlorian Schrenk (til venstre) og Christoph Rameshan. Kredit:Vienna University of Technology Hvor som helst produktionen af skadelige drivhusgasser ikke kan forhindres, bør de omdannes til noget n
Genbrug af drivhusgasser:Nanopartikler på perovskitkrystaller undgår kokseffektFlorian Schrenk (til venstre) og Christoph Rameshan. Kredit:Vienna University of Technology Hvor som helst produktionen af skadelige drivhusgasser ikke kan forhindres, bør de omdannes til noget n -
 Forskere udvikler 3D-printet geléHydrogelmaterialet kommer fra tangpartikler af forskellig størrelse. Kredit:Orlin Velev, NC State University 3D-printbare geler med forbedrede og meget kontrollerede egenskaber kan skabes ved at f
Forskere udvikler 3D-printet geléHydrogelmaterialet kommer fra tangpartikler af forskellig størrelse. Kredit:Orlin Velev, NC State University 3D-printbare geler med forbedrede og meget kontrollerede egenskaber kan skabes ved at f -
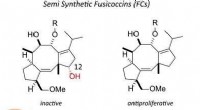 Redigeret plantebaseret toksin besidder antitumoregenskaberFusicoccin, et fytotoksin, blev omdannet til en række antiproliferative midler til tumorceller ved at fjerne 12-hydroxylgruppen. Disse forbindelser blev vist at opregulere interaktion mellem 1433 og e
Redigeret plantebaseret toksin besidder antitumoregenskaberFusicoccin, et fytotoksin, blev omdannet til en række antiproliferative midler til tumorceller ved at fjerne 12-hydroxylgruppen. Disse forbindelser blev vist at opregulere interaktion mellem 1433 og e


